解题方法
1 . 副族元素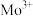 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液_______ ;锰在周期表中的_______ 区。
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为_______ 。
(3)副族元素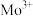 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是_______ ; 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是_______ (填元素符号),其中配体中C原子的杂化方式为_______ , 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为_______ 。
(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是_______ 。
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。_______ ;
② 的熔点
的熔点_______ (填“>”、“<”或“=”) ;
;
③若该八面体边长为 ,则晶胞的密度为
,则晶胞的密度为
_______  (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
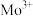 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液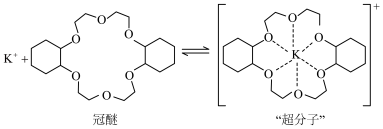
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为
(3)副族元素
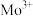 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。

②
 的熔点
的熔点 ;
;③若该八面体边长为
 ,则晶胞的密度为
,则晶胞的密度为
 (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
您最近一年使用:0次
名校
解题方法
2 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为_______ ;基态 较基态
较基态 更稳定的原因是
更稳定的原因是_______ 。
(2) 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。
(3) 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有_______ 个;C、N、F的电负性由大到小的顺序为_______ 。
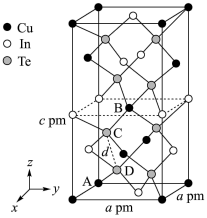
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为_______ ;该晶体的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为(0,0,0)、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ ,晶胞中C、D间距离
_______ pm。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为 较基态
较基态 更稳定的原因是
更稳定的原因是(2)
 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。A. | B. | C.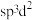 | D. |
(3)
 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 ,则C点原子的分数坐标为
,则C点原子的分数坐标为

您最近一年使用:0次
2024-04-04更新
|
700次组卷
|
3卷引用:2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学
2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学
名校
解题方法
3 . 二茂铁( )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,若受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态简化电子排布式:___________ 。
(2)羰基铁粉[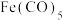 ]中铁元素的配位数是
]中铁元素的配位数是___________ ,配位原子为___________ 。
(3)二茂铁的衍生物可和 等微粒产生静电作用,H、B、O和C的电负性由大到小的顺序为;
等微粒产生静电作用,H、B、O和C的电负性由大到小的顺序为;___________ ; 空间构型为
空间构型为_________ 。 的键角比
的键角比 的
的_______ (填“大”或“小”)
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。

一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)羰基铁粉[
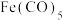 ]中铁元素的配位数是
]中铁元素的配位数是(3)二茂铁的衍生物可和
 等微粒产生静电作用,H、B、O和C的电负性由大到小的顺序为;
等微粒产生静电作用,H、B、O和C的电负性由大到小的顺序为; 空间构型为
空间构型为 的键角比
的键角比 的
的(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次
4 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: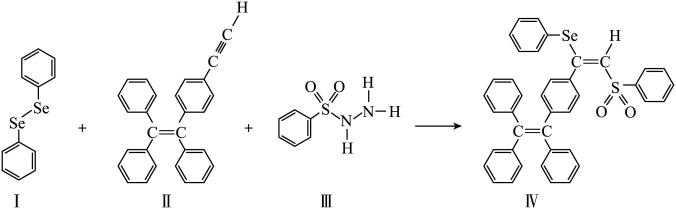
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
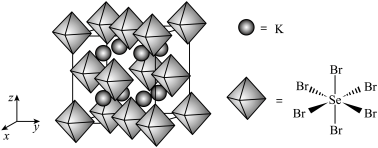
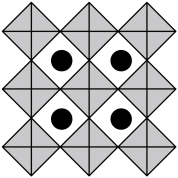
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-06-10更新
|
12648次组卷
|
28卷引用:四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题
四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)T35-物质结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题上海市实验学校2023-2024学年高三上学期第一次月考化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题广东省广州中学2022-2023学年高二下学期期中考试化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题广东省广州市第六十五中学2023-2024学年高二下学期期中考试化学试题
5 . 中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是___ ,基态Zn价电子排布式为___ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为___ 。
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是___ 。
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是___ 。
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为___ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___ 。
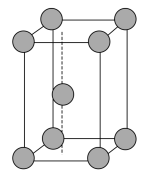
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是___ (用含π的代数式表示)。
(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是

您最近一年使用:0次
解题方法
6 . Ni元素在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Ni原子价层电子的排布式为__ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行__ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是__ ;(SCN)2分子中,硫原子的杂化方式是__ ,σ键和π键数目之比为__ 。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为__ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键 e.共价键
(5)镍合金储氢的研究已取得很大进展。

①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金可吸附H2的数目为__ 。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的__ (填“八面体空隙”或“四面体空隙”)。若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为___ nm(用含d、M、NA的代数式表示)。
(1)基态Ni原子价层电子的排布式为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为
a.离子键 b.金属键 c.配位键 d.氢键 e.共价键
(5)镍合金储氢的研究已取得很大进展。

①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金可吸附H2的数目为
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的
您最近一年使用:0次
名校
解题方法
7 . 铁及其化合物广泛存在于人们的日常生活和工业生产中。回答下列问题:
(1)基态Fe原子的核外电子排布式是________ ,Ca元素与Fe元素同周期,灼烧 ,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是
,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
(2)人体内血红蛋白的结构简式如图所示:
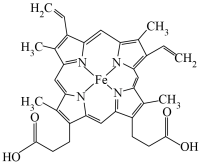
①组成血红蛋白的5种元素中,电负性由大到小的顺序是_________ ,C、N、O的第一电离能由大到小的顺序是_______ 。
②血红蛋白分子结构中N的杂化方式是_______ 。
③血红蛋白分子结构中含有配位键,为这些配位键提供孤电子对的元素是_______ (写元素符号,下同),提供空轨道的元素是______ 。
(3) 可应用于工业生产中的催化剂,其晶胞结构如图所示:
可应用于工业生产中的催化剂,其晶胞结构如图所示:

①已知电负性:Fe-1.83,Br-2.96,则 中含有的化学键类型为
中含有的化学键类型为_________ 。
② 晶胞中铁的配位数是
晶胞中铁的配位数是_________ ; 晶胞边长为a cm,则
晶胞边长为a cm,则 晶体密度的表达式为
晶体密度的表达式为_____________  (设阿伏加 德罗常数的值为NA)。
(设阿伏加 德罗常数的值为NA)。
(1)基态Fe原子的核外电子排布式是
 ,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是
,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是(2)人体内血红蛋白的结构简式如图所示:

①组成血红蛋白的5种元素中,电负性由大到小的顺序是
②血红蛋白分子结构中N的杂化方式是
③血红蛋白分子结构中含有配位键,为这些配位键提供孤电子对的元素是
(3)
 可应用于工业生产中的催化剂,其晶胞结构如图所示:
可应用于工业生产中的催化剂,其晶胞结构如图所示:
①已知电负性:Fe-1.83,Br-2.96,则
 中含有的化学键类型为
中含有的化学键类型为②
 晶胞中铁的配位数是
晶胞中铁的配位数是 晶胞边长为a cm,则
晶胞边长为a cm,则 晶体密度的表达式为
晶体密度的表达式为 (设阿伏加 德罗常数的值为NA)。
(设阿伏加 德罗常数的值为NA)。
您最近一年使用:0次



