四川省眉山市仁寿第一中学2020届高三上学期模拟考试理综化学试题
四川
高三
阶段练习
2020-04-16
294次
整体难度:
容易
考查范围:
认识化学科学、常见无机物及其应用、有机化学基础、化学反应原理、物质结构与性质、化学实验基础
四川省眉山市仁寿第一中学2020届高三上学期模拟考试理综化学试题
四川
高三
阶段练习
2020-04-16
294次
整体难度:
容易
考查范围:
认识化学科学、常见无机物及其应用、有机化学基础、化学反应原理、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
1. 古代方士、道家炼制外丹常用的八种石质原料(即“八石”)为朱砂(HgS)、雄黄(As4S4)、雌黄(As2S3)、空青[Cu2(OH)2CO3]、云母[KAl2(AlSi3O10)(OH)x]、硫黄、戎盐(NaCl)、硝石(KNO3)(括号内为主要成分的化学式)。下列说法正确的是
| A.雄黄、雌黄、硫黄的主要成分均为含硫化合物 |
| B.空青、戎盐、硝石的主要成分均易溶于水 |
| C.云母主要成分的化学式中x的值为2 |
D.朱砂与O2能发生反应:2HgS+3O2 2HgO+2SO2,该反应属于置换反应 2HgO+2SO2,该反应属于置换反应 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
2. 分子中含有三个以上-OCH2CH2O-重复单元的有机物叫冠醚,18-冠-6的结构简式如图所示:
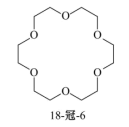
下列说法正确的是

下列说法正确的是
| A.18-冠-6中的“18”指分子含有18个碳原子,“6”指分子含有6个氧原子 |
| B.该分子中所有原子可能共平面 |
| C.该分子的一氯代物只有1种 |
| D.该有机物的最简式和葡萄糖的相同 |
【知识点】 同分异构体的数目的确定解读 有机分子中原子共面的判断解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
3. NA为阿伏加 德罗常数的值。下列说法错误的是
| A.128 g HI加热充分分解生成氢气的分子数为0.5NA |
| B.15 g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA |
| C.标准状况下,1.12 L氖气与1.12 L甲烷所含质子总数均为0.5NA |
D.0.2mol 与0.5mol 与0.5mol 在光照下充分反应,产物中C—Cl键总数为0.5NA 在光照下充分反应,产物中C—Cl键总数为0.5NA |
您最近一年使用:0次
2020-04-13更新
|
178次组卷
|
4卷引用:四川省眉山市仁寿第一中学2020届高三上学期模拟考试理综化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 通过下列装置(部分夹持仪器已省略)可制取1,2-二溴乙烷。下列说法正确的是
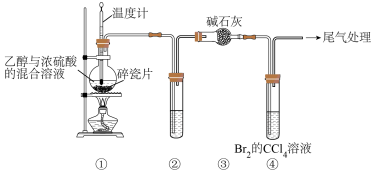
已知:烧瓶中反应后逸出的气体主要是CH2=CH2,含少量SO2、CO2及H2O(g)。

已知:烧瓶中反应后逸出的气体主要是CH2=CH2,含少量SO2、CO2及H2O(g)。
| A.配制“乙醇与浓硫酸的混合溶液”时,将乙醇注入浓硫酸中并搅拌 |
| B.②的试管中可盛放酸性KMnO4溶液以除去SO2 |
| C.④中的Br2已完全与乙烯加成的现象是:溶液由橙色变为无色 |
| D.可用分液漏斗从④反应后的混合物中分离出1,2-二溴乙烷并回收CCl4 |
【知识点】 乙烯的氧化反应 乙烯的加成反应解读 实验室制备乙烯综合考查解读
您最近一年使用:0次
2020-04-13更新
|
465次组卷
|
3卷引用:四川省眉山市仁寿第一中学2020届高三上学期模拟考试理综化学试题
四川省眉山市仁寿第一中学2020届高三上学期模拟考试理综化学试题(已下线)2020年高考化学押题预测卷01(新课标Ⅱ卷)--《2020年高考押题预测卷》河南省南阳市2018-2019学年高一下学期期末考试化学试题
单选题
|
较易(0.85)
名校
解题方法
5. 目前大多数城市采用雨污分流的排水体制,污水汇集到一起,进行集中处理。如图是电解法处理某生活污水的装置:
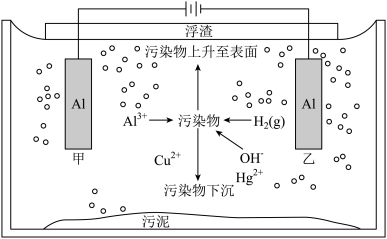
下列叙述正确的是

下列叙述正确的是
| A.甲、乙两个电极均为消耗型电极,不能用石墨代替 |
| B.电解开始时,阴极反应为2H2O+2e-=H2↑+2OH-,阴极区pH升高 |
| C.当阳极有9.0gAl溶解时,阴极一定增重100.5g或32.0g |
| D.污水中污染物的除去是阳极反应与阴极反应协同作用的结果 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
6. 短周期主族元素R、X、Y、Z的原子序数依次增大,R原子的电子数是内层电子数的3倍,X的单质能与盐酸反应产生H2,Y的最高价氧化物能与烧碱反应生成盐和水,Z的最高正价和最低负价之和等于4,下列说法正确的是
| A.原子半径:X<Y<Z<R |
| B.单质的还原性:Y<Z |
| C.工业上,常用电解法制备X的单质 |
| D.Z的氧化物对应的水化物一定是强酸 |
您最近一年使用:0次
2020-03-04更新
|
100次组卷
|
2卷引用:2019年天一大联考高三六联理综——化学试题
单选题
|
较易(0.85)
7. 常温下,用0.100 的盐酸滴定100mL0.100
的盐酸滴定100mL0.100 的氨水,滴定曲线如图所示:
的氨水,滴定曲线如图所示:
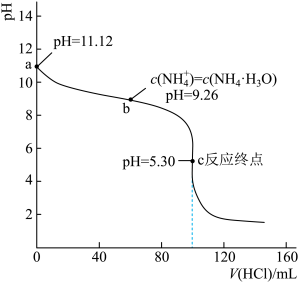
下列说法正确的是
 的盐酸滴定100mL0.100
的盐酸滴定100mL0.100 的氨水,滴定曲线如图所示:
的氨水,滴定曲线如图所示:
下列说法正确的是
| A.用酚酞作指示剂比用甲基橙作指示剂滴定误差小 |
| B.在点a处,氨水的电离度α的对数值lgα=-1.88 |
C.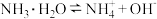 的 的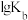 =-9.26 =-9.26 |
| D.a、b、c三点溶液中水的电离程度:a>b>c |
【知识点】 水的电离 酸碱中和滴定指示剂选择解读 电离平衡常数及影响因素解读
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
8. 锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01mol•L-1的HMnO4溶液的pH=_____________ 。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)⇌PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 mol•L-1,则c(Pb2+)=______________ [已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4•H2O)的流程如图所示:
①MnSO4中含有的化学键类型有_______________ 。
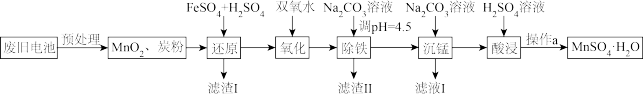
②滤渣Ⅱ的主要成分是____________ ,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________ ,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________ (填字母)。
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO3•6Mn(OH)2•5H2O生成,写出相应反应的化学方程式_________ 。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01mol•L-1的HMnO4溶液的pH=
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)⇌PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 mol•L-1,则c(Pb2+)=
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4•H2O)的流程如图所示:

①MnSO4中含有的化学键类型有
②滤渣Ⅱ的主要成分是

a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO3•6Mn(OH)2•5H2O生成,写出相应反应的化学方程式
您最近一年使用:0次
9. 硫化氢大量存在于天然气及液化石油气中,近年来发现 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解 包括下列反应:
包括下列反应:
Ⅰ.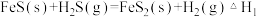
Ⅱ.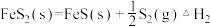
Ⅲ.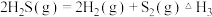
①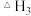 =
=____________ (用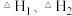 表示)。
表示)。
②已知单质硫气态时以 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339 、E(H-H)=436
、E(H-H)=436 、E(S=S)=225
、E(S=S)=225 ,则
,则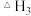 =
=____________  。
。
③ 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价, 的电子式为
的电子式为______________ 。
(2)银器长期露置在含 的空气中表面会生成
的空气中表面会生成 而变黑,该反应的氧化剂为
而变黑,该反应的氧化剂为________ ;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________ 。
(3)实验室用粗锌制取氢气时常含有少量的 ,可用酸性
,可用酸性 溶液(
溶液( 被还原为
被还原为 )将
)将 氧化为S而除去,该反应的离子方程式为
氧化为S而除去,该反应的离子方程式为_______ 。
(4) 与
与 合成硫醇
合成硫醇 的反应
的反应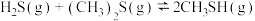 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时 的平衡转化率如图所示:
的平衡转化率如图所示:

①该反应的
______ 0(填“>”或“<");
_________  (填“>”或“<”)。
(填“>”或“<”)。
②在2L密闭容器中充入0.2mol 和0.1mol
和0.1mol ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________ 。
③为提高 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:(1)D.Berk等学者设计的用FeS催化分解
 包括下列反应:
包括下列反应:Ⅰ.
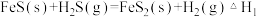
Ⅱ.
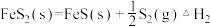
Ⅲ.
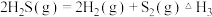
①
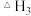 =
=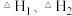 表示)。
表示)。②已知单质硫气态时以
 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339 、E(H-H)=436
、E(H-H)=436 、E(S=S)=225
、E(S=S)=225 ,则
,则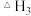 =
= 。
。③
 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价, 的电子式为
的电子式为(2)银器长期露置在含
 的空气中表面会生成
的空气中表面会生成 而变黑,该反应的氧化剂为
而变黑,该反应的氧化剂为(3)实验室用粗锌制取氢气时常含有少量的
 ,可用酸性
,可用酸性 溶液(
溶液( 被还原为
被还原为 )将
)将 氧化为S而除去,该反应的离子方程式为
氧化为S而除去,该反应的离子方程式为(4)
 与
与 合成硫醇
合成硫醇 的反应
的反应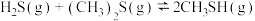 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时 的平衡转化率如图所示:
的平衡转化率如图所示:
①该反应的


 (填“>”或“<”)。
(填“>”或“<”)。②在2L密闭容器中充入0.2mol
 和0.1mol
和0.1mol ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=③为提高
 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是【知识点】 化学反应热的计算 化学平衡的移动及其影响因素 化学平衡的有关计算 原电池原理
您最近一年使用:0次
2020-04-13更新
|
90次组卷
|
2卷引用:四川省眉山市仁寿第一中学2020届高三上学期模拟考试理综化学试题
解答题-实验探究题
|
较易(0.85)
名校
10. 黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
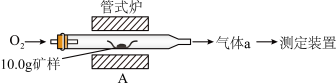
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________ 。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。
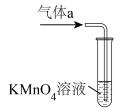
①KMnO4溶液氧化SO2的离子方程式为________________ 。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________ 。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________ (填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________ 。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的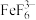 ,其目的是
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 mol•L-1 Na2S2O3标准溶液滴定生成的I2,以___________ 作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________ (已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。

若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。

①KMnO4溶液氧化SO2的离子方程式为
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的
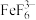 ,其目的是
,其目的是②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 mol•L-1 Na2S2O3标准溶液滴定生成的I2,以
【知识点】 氧化还原反应方程式的配平解读 氢氧化铁化学性质解读 物质含量的测定
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
名校
解题方法
11. 铁及其化合物广泛存在于人们的日常生活和工业生产中。回答下列问题:
(1)基态Fe原子的核外电子排布式是________ ,Ca元素与Fe元素同周期,灼烧 ,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是
,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
(2)人体内血红蛋白的结构简式如图所示:
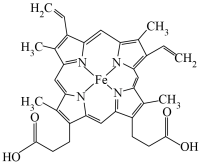
①组成血红蛋白的5种元素中,电负性由大到小的顺序是_________ ,C、N、O的第一电离能由大到小的顺序是_______ 。
②血红蛋白分子结构中N的杂化方式是_______ 。
③血红蛋白分子结构中含有配位键,为这些配位键提供孤电子对的元素是_______ (写元素符号,下同),提供空轨道的元素是______ 。
(3) 可应用于工业生产中的催化剂,其晶胞结构如图所示:
可应用于工业生产中的催化剂,其晶胞结构如图所示:

①已知电负性:Fe-1.83,Br-2.96,则 中含有的化学键类型为
中含有的化学键类型为_________ 。
② 晶胞中铁的配位数是
晶胞中铁的配位数是_________ ; 晶胞边长为a cm,则
晶胞边长为a cm,则 晶体密度的表达式为
晶体密度的表达式为_____________  (设阿伏加 德罗常数的值为NA)。
(设阿伏加 德罗常数的值为NA)。
(1)基态Fe原子的核外电子排布式是
 ,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是
,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是(2)人体内血红蛋白的结构简式如图所示:

①组成血红蛋白的5种元素中,电负性由大到小的顺序是
②血红蛋白分子结构中N的杂化方式是
③血红蛋白分子结构中含有配位键,为这些配位键提供孤电子对的元素是
(3)
 可应用于工业生产中的催化剂,其晶胞结构如图所示:
可应用于工业生产中的催化剂,其晶胞结构如图所示:
①已知电负性:Fe-1.83,Br-2.96,则
 中含有的化学键类型为
中含有的化学键类型为②
 晶胞中铁的配位数是
晶胞中铁的配位数是 晶胞边长为a cm,则
晶胞边长为a cm,则 晶体密度的表达式为
晶体密度的表达式为 (设阿伏加 德罗常数的值为NA)。
(设阿伏加 德罗常数的值为NA)。
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
名校
解题方法
12. 有机化合物M是一种治疗恶性肿瘤的合成药物。制备M的一种合成路线如图所示:
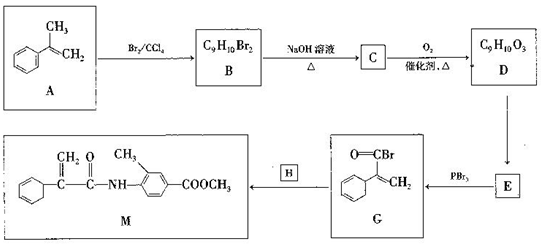
已知: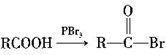 (R为烃基)。
(R为烃基)。
(1)A的化学名称是________ 。
(2)由A生成B和B生成C的反应类型分别是_________ 、________ 。
(3)由C生成D的化学方程式是____________________ 。
(4)写出E的结构简式:________ ,X是E 的同分异构体,且X满足下列条件:
①能发生银镜反应;②遇浓FeCl3 溶液变色;③分子结构中只含一个碳环结构。
符合上述条件的X 有_____ 种,其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1的结构简式是_____________ 。
(5)根据题给信息,写出用CH3CHO和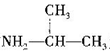 为原料制备
为原料制备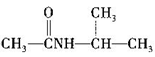 的合成路线:
的合成路线:_________________ (其他试剂任选)。

已知:
 (R为烃基)。
(R为烃基)。(1)A的化学名称是
(2)由A生成B和B生成C的反应类型分别是
(3)由C生成D的化学方程式是
(4)写出E的结构简式:
①能发生银镜反应;②遇浓FeCl3 溶液变色;③分子结构中只含一个碳环结构。
符合上述条件的X 有
(5)根据题给信息,写出用CH3CHO和
 为原料制备
为原料制备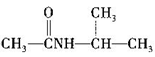 的合成路线:
的合成路线:
您最近一年使用:0次
2018-04-20更新
|
253次组卷
|
2卷引用:河南省天一大联考2018届高三阶段性测试(五)(河南版) 理科综合化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、有机化学基础、化学反应原理、物质结构与性质、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 四种基本反应类型 硫在自然界中的存在 | |
| 2 | 0.85 | 同分异构体的数目的确定 有机分子中原子共面的判断 | |
| 3 | 0.85 | 物质的量有关计算 结合物质结构基础知识与NA相关推算 甲烷的取代反应 | |
| 4 | 0.85 | 乙烯的氧化反应 乙烯的加成反应 实验室制备乙烯综合考查 | |
| 5 | 0.85 | 电解原理 电解原理的应用 | |
| 6 | 0.65 | 元素周期律、元素周期表的推断 根据物质性质进行元素种类推断 | |
| 7 | 0.85 | 水的电离 酸碱中和滴定指示剂选择 电离平衡常数及影响因素 | |
| 二、解答题 | |||
| 8 | 0.65 | 氧化还原反应方程式的配平 强电解质和弱电解质的判断 溶度积常数相关计算 物质分离、提纯综合应用 | 原理综合题 |
| 9 | 0.65 | 化学反应热的计算 化学平衡的移动及其影响因素 化学平衡的有关计算 原电池原理 | 原理综合题 |
| 10 | 0.85 | 氧化还原反应方程式的配平 氢氧化铁化学性质 物质含量的测定 | 实验探究题 |
| 11 | 0.65 | 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 简单配合物的成键 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 同分异构体的数目的确定 羧酸化学性质 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



