“无机”碳化学的一个重要领域是含有C—N键的化合物,其中重要的化合物有氰 、氰化氢、氰化物、氰酸盐等。回答下列问题:
、氰化氢、氰化物、氰酸盐等。回答下列问题:
(1)基态 的价层电子轨道表示式为
的价层电子轨道表示式为_______ 。
(2) 与卤素性质相似,与
与卤素性质相似,与 反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为
反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为_______ , 中C原子的杂化方式为
中C原子的杂化方式为_______ 。
(3)科学家研究发现,在低温下,HCN可结晶成晶体,在晶体中HCN分子排列可形成 的无限长链,其原因是
的无限长链,其原因是_______ ;写出 分子的链状结构
分子的链状结构_______ 。
(4)将氰化物与氟化物或氯化物一起反应,即可得FCN和ClCN,它们的沸点数据如下表所示:
ClCN的沸点比FCN的沸点高原因是_______ 。
(5)氰酸根离子可与大多数金属阳离子形成氰化物,几种金属氰化物的晶胞转化关系如图一所示,从普鲁士蓝晶胞中切出 的结构,如图二所示。
的结构,如图二所示。

①下列说法正确的是_______ (填标号)。
A.每个普鲁士蓝晶胞中含6个 键
键
B.普鲁士白的化学式为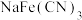
C.格林绿晶体中 周围等距且最近的
周围等距且最近的 数目为12
数目为12
②已知普鲁士白晶胞的晶胞参数均为a pm,设 为阿伏加德罗常数的值,则普鲁士白晶体密度为
为阿伏加德罗常数的值,则普鲁士白晶体密度为_______  (用含
(用含 、
、 、
、 计算式表示)。
计算式表示)。
 、氰化氢、氰化物、氰酸盐等。回答下列问题:
、氰化氢、氰化物、氰酸盐等。回答下列问题:(1)基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)
 与卤素性质相似,与
与卤素性质相似,与 反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为
反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为 中C原子的杂化方式为
中C原子的杂化方式为(3)科学家研究发现,在低温下,HCN可结晶成晶体,在晶体中HCN分子排列可形成
 的无限长链,其原因是
的无限长链,其原因是 分子的链状结构
分子的链状结构(4)将氰化物与氟化物或氯化物一起反应,即可得FCN和ClCN,它们的沸点数据如下表所示:
| FCN | ClCN | |
| 沸点/K | 227 | 286 |
(5)氰酸根离子可与大多数金属阳离子形成氰化物,几种金属氰化物的晶胞转化关系如图一所示,从普鲁士蓝晶胞中切出
 的结构,如图二所示。
的结构,如图二所示。
①下列说法正确的是
A.每个普鲁士蓝晶胞中含6个
 键
键B.普鲁士白的化学式为
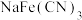
C.格林绿晶体中
 周围等距且最近的
周围等距且最近的 数目为12
数目为12②已知普鲁士白晶胞的晶胞参数均为a pm,设
 为阿伏加德罗常数的值,则普鲁士白晶体密度为
为阿伏加德罗常数的值,则普鲁士白晶体密度为 (用含
(用含 、
、 、
、 计算式表示)。
计算式表示)。
2024·四川德阳·二模 查看更多[2]
更新时间:2024-03-13 11:49:20
|
相似题推荐
【推荐1】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。基态A元素原子的价电子排布式为 ;C元素为最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能
(2)基态D元素原子的价电子排布式为
(3)基态C元素原子的电子排布图为
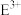 的离子符号为
的离子符号为(4)F元素位于元素周期表的
(5)G元素可能的性质是______(填字母)。
| A.其单质可作为半导体材料 | B.其电负性大于磷 |
| C.其原子半径大于锗 | D.其第一电离能小于硒 |
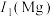
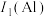 ,其原因是
,其原因是
您最近一年使用:0次
【推荐2】石墨烯、高温氯化钠、砷化镉等超导材料应用广泛。回答下列问题:
(1)石墨烯结构如图1所示,则碳原子的杂化方式为_______ ,12 g石墨烯中含有六元环个数与σ键个数之比为_______ 。
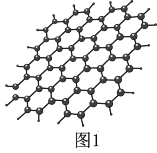
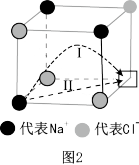
(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径_______ (填图中序号)迁移到空位处。
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由_______ 。
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为_______ ;与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3强于PH3,原因是_______ 。
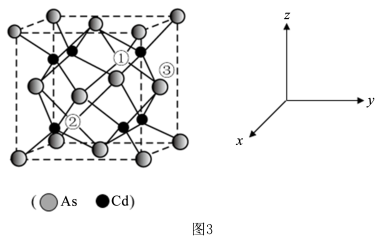
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3, 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞的密度为 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为_______ pm(列计算式即可)。
(1)石墨烯结构如图1所示,则碳原子的杂化方式为

(2)温度升高时,NaCl晶体出现缺陷,如图2方格处填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
,此时晶体的导电性大大增强。已知氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则Na+最可能通过途径
(3)石墨烯限域单原子铁催化剂使CH4在室温条件下被H2O2直接氧化为HCHO、HCOOH,比较HCHO、HCOOH的沸点高低并说明理由
(4)镉(Cd)与Zn同族且相邻,则基态Cd原子的价电子排布式为
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构为正方体如图3,
 占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
占据顶点和面心,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,其中“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为 ,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
,阿伏加德罗常数的值为NA,则该晶胞中距离最远的两个Cd原子之间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。请回答:
(1)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______ 。与CN-互为等电子体的一种分子为_______ (填化学式)。
(2)Ti(BH4)2是一种储氢材料。写出基态Ti的价电子排布式_______ ,BH 的空间构型是
的空间构型是_______ 。
(3)[Cr(H2O)4Cl2]Cl·2H2O中提供孤对电子的原子为_______ ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为_______
(5)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点FeO_______ NiO (填“>”或“<”)。
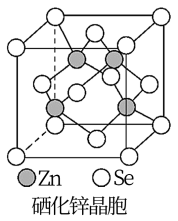
(6)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为_______ ;若该晶胞密度为d g·cm-3, 硒化锌的摩尔质量为mg/mol。NA代表阿伏加德罗常数,则晶胞参数a为_______ cm。
(1)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为
(2)Ti(BH4)2是一种储氢材料。写出基态Ti的价电子排布式
 的空间构型是
的空间构型是(3)[Cr(H2O)4Cl2]Cl·2H2O中提供孤对电子的原子为
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为
(5)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点FeO
(6)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】ⅣA族元素及其化合物在材料等方面有重要用途 回答下列问题:
回答下列问题:
(1)碳的一种单质的结构如图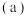 所示
所示 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为______
(2) 分子的立体构型为
分子的立体构型为______ ,属于______ 分子(填“极性”或“非极性”)
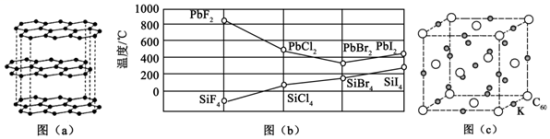
(3)四卤化硅 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图
的熔点如图 所示.
所示.
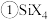 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是______
 结合
结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性______ (填“增强”“不变”或“减弱)
(4)碳的另一种单质 可以与钾形成低温超导化合物,晶体结构如图
可以与钾形成低温超导化合物,晶体结构如图 所示
所示 位于立方体的棱上和立方体的内部,此化合物的化学式为
位于立方体的棱上和立方体的内部,此化合物的化学式为______ ,其晶胞参数为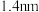 ,晶体密度为
,晶体密度为______  (列计算式)
(列计算式)
 回答下列问题:
回答下列问题:(1)碳的一种单质的结构如图
 所示
所示 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为
(2)
 分子的立体构型为
分子的立体构型为(3)四卤化硅
 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图
的熔点如图 所示.
所示.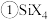 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是 结合
结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键的离子性
中的化学键的离子性(4)碳的另一种单质
 可以与钾形成低温超导化合物,晶体结构如图
可以与钾形成低温超导化合物,晶体结构如图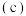 所示
所示 位于立方体的棱上和立方体的内部,此化合物的化学式为
位于立方体的棱上和立方体的内部,此化合物的化学式为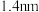 ,晶体密度为
,晶体密度为 (列计算式)
(列计算式)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】铬、铜、硼在很多领域有重要用途。请回答下列问题:
(1)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1∶1,一个该分子中含有_______ 个σ键。
(2)元素铬化合物 在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数为2的副族元素有_______ 种。
②在a:苯 b: c:HCHO d:
c:HCHO d: e:
e: 。上述五种有机溶剂,碳原子采取
。上述五种有机溶剂,碳原子采取 杂化的分子有
杂化的分子有_______ (填字母)。
(3)硼砂是含结晶水的四硼酸钠,其阴离子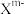 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示:

在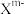 中,硼原子轨道的杂化类型有
中,硼原子轨道的杂化类型有_______ ;m=_______ (填数字)。
(1)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1∶1,一个该分子中含有
(2)元素铬化合物
 在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。①与铬同周期的基态原子中最外层电子数为2的副族元素有
②在a:苯 b:
 c:HCHO d:
c:HCHO d: e:
e: 。上述五种有机溶剂,碳原子采取
。上述五种有机溶剂,碳原子采取 杂化的分子有
杂化的分子有(3)硼砂是含结晶水的四硼酸钠,其阴离子
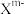 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示:
在
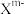 中,硼原子轨道的杂化类型有
中,硼原子轨道的杂化类型有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ、Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH 和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+基态核外电子排布式为________ 。
(2)SO42﹣的空间构型为_________ (用文字描述),Cu2+与 OH-反应能生成[Cu(OH)4 ]2-, [Cu(OH)4]2-中的配位原子为_______ (填元素符号)。
(3)抗坏血酸的分子结构如图 1 所示,分子中碳原子的轨道杂化类型为________ ;推测抗坏血酸在水中的溶解性:_______ (填“难溶于水”或“易溶于水”)。
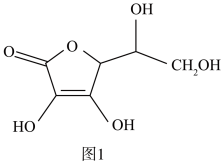
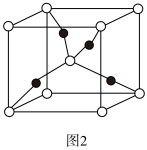
(4)一个 Cu2O 晶胞(如图 2)中,Cu 原子的数目为_________ 。
Ⅱ、磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 FeCl3、NH4H2PO4、LiCl 和苯胺等作为原料制备。回答下列问题:
(5)在周期表中,与 Li 的化学性质最相似的邻族元素是___ ,该元素基态原子核外 M层电子的自旋状态_______ (填“相同”或“相反”)。
(6)苯胺(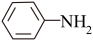 )的晶体类型是
)的晶体类型是_________ 。苯胺与甲苯(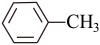 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________ 。
(1)Cu2+基态核外电子排布式为
(2)SO42﹣的空间构型为
(3)抗坏血酸的分子结构如图 1 所示,分子中碳原子的轨道杂化类型为


(4)一个 Cu2O 晶胞(如图 2)中,Cu 原子的数目为
Ⅱ、磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 FeCl3、NH4H2PO4、LiCl 和苯胺等作为原料制备。回答下列问题:
(5)在周期表中,与 Li 的化学性质最相似的邻族元素是
(6)苯胺(
 )的晶体类型是
)的晶体类型是 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】已知A、B、C、D、E、F为原子序数依次增大的前30号元素,A的一种同位素原子无中子;B元素基态原子的核外电子数是其能级数的2倍,且含有未成对的电子;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3:1;E为周期表中电负性最强的元素;F为第四周期元素,其+1价阳离子的核外电子排布式为[Ar]3d10.回答下列问题(用元素符号或化学式表示):
(1)E元素原子的价电子排布式为:___________ ,C元素基态原子的价电子排布图为:___________ 。
(2)F在元素周期表中的位置:___________ ,位于___________ 区。
(3)B、C、D的第一电离能由大到小的顺序为___________ (填元素符号)。
(4)元素A和D可形成物质甲A2D,甲的熔沸点比同主族的氢化物的熔沸点高,试分析原因:___________ 。
(5)A、C形成的化合物乙常用作制冷剂,乙的电子式为___________ ,属于___________ (填“极性”或“非极性”)分子。
(6)由A、B、D三种元素形成生活中常见的化合物B2A6D分子中含___________ 个σ键。
(1)E元素原子的价电子排布式为:
(2)F在元素周期表中的位置:
(3)B、C、D的第一电离能由大到小的顺序为
(4)元素A和D可形成物质甲A2D,甲的熔沸点比同主族的氢化物的熔沸点高,试分析原因:
(5)A、C形成的化合物乙常用作制冷剂,乙的电子式为
(6)由A、B、D三种元素形成生活中常见的化合物B2A6D分子中含
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】下表是元素周期表的一部分。表中所列的字母分别代表一种元素。

回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式:___________ 。
(2)D的简单气态氢化物的VSEPR模型为___________ ,分子的空间结构为___________ 。
(3)第一电离能H___________ X(填“>”“<”或“=”),其原因是___________ 。
(4)电负性E___________ M(填“>”“<”或“=”)。
(5)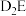 的沸点比
的沸点比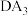 的沸点低,其原因是
的沸点低,其原因是___________ 。
(6) 的空间结构为
的空间结构为___________ ,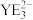 的键角比
的键角比 的键角小的原因是
的键角小的原因是___________ 。

回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式:
(2)D的简单气态氢化物的VSEPR模型为
(3)第一电离能H
(4)电负性E
(5)
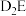 的沸点比
的沸点比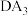 的沸点低,其原因是
的沸点低,其原因是(6)
 的空间结构为
的空间结构为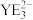 的键角比
的键角比 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】一种从餐饮废弃油脂中获取生物柴油及甘油的工艺流程如图:

(1)“酯交换”"过程发生的主要反应为:
 +3CH3OH
+3CH3OH
 +R1COOCH3+R2COOCH3+R3COOCH3
+R1COOCH3+R2COOCH3+R3COOCH3
①投料时, 为9的原因有甲醇做溶剂、
为9的原因有甲醇做溶剂、____ 。
②“酯交换”的催化机理如图。

物质a的结构简式为____ ,b的结构简式为____ 。
(2)“调pH过程,生成KH2PO4和R1COOH的离子方程式为____ 。
(3)当温度高于240℃、压力高于7.86MPa,甲醇处于超临界状态,兼具液体和气体的优点。SRCA生物柴油工艺就是利用超临界甲醇和油脂直接进行酯交换。下列相关分析错误的是____ (填字母序号)。

(1)“酯交换”"过程发生的主要反应为:
 +3CH3OH
+3CH3OH
 +R1COOCH3+R2COOCH3+R3COOCH3
+R1COOCH3+R2COOCH3+R3COOCH3①投料时,
 为9的原因有甲醇做溶剂、
为9的原因有甲醇做溶剂、②“酯交换”的催化机理如图。

物质a的结构简式为
(2)“调pH过程,生成KH2PO4和R1COOH的离子方程式为
(3)当温度高于240℃、压力高于7.86MPa,甲醇处于超临界状态,兼具液体和气体的优点。SRCA生物柴油工艺就是利用超临界甲醇和油脂直接进行酯交换。下列相关分析错误的是
| A.温度升高,甲醇分子间的氢键被削弱,在油脂中的溶解能力增强 |
| B.温度升高,促进甲醇解离,增加了活化分子百分数 |
| C.酯交换为放热反应,升温有利于平衡正向移动 |
| D.增加甲醇的使用量,有利于提高平衡常数 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钛和钛的化合物用途比较广泛。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有__ 种,基态钛原子的价电子排布式为__ ,该基态原子最外层的电子电子云轮廓图为__ 。
(2)C、O和Ti电负性由大到小的顺序为__ 。
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为__ 和___ (填化学式)。
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为__ 。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是__ (填“碳”或“氧”)原子。
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___ 。H4SiO4中Si的轨道杂化类型为__ 。
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。
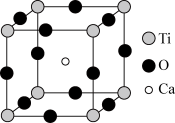
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__ 个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为___ g/cm3。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有
(2)C、O和Ti电负性由大到小的顺序为
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。

(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】人们发现,纸张会发生酸性腐蚀而变脆、破损,这严重威胁纸质文物的保存。经分析检验发现,酸性腐蚀主要与造纸中涂敷明矾的工艺有关,为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂。回答下列问题:
(1)上述涉及的物质中,原子序数最大的元素是___________ (填化学符号),其位于元素周期表中的___________ 区。
(2)H、C、O元素的电负性由大到小的顺序为___________ (用元素符号表示)。
(3)熔融 可生成具有挥发性的二聚体,二聚体
可生成具有挥发性的二聚体,二聚体 的结构式为
的结构式为___________ ,其中Al的配位数为___________ 。
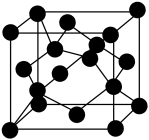
(4) 的一种晶胞结构如图所示。
的一种晶胞结构如图所示。

① 属于
属于___________ (填“离子”或“共价”)化合物。
②下列说法错误的是___________ (填标号)。
A. 晶体有较高的熔、沸点 B.
晶体有较高的熔、沸点 B. 晶体硬而脆
晶体硬而脆
C. 晶体易溶于水 D.
晶体易溶于水 D. 晶体不导电
晶体不导电
③若将 形成的立方体分割成8个小立方体,则每个小立方体的中心有
形成的立方体分割成8个小立方体,则每个小立方体的中心有___________ 个 。
。
(5)由碳元素形成的某种晶体的晶胞结构如图所示,设阿伏加德罗常数的值为 ,晶体的密度为
,晶体的密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为___________ (用含 、
、 的代数式表示)pm。
的代数式表示)pm。
(1)上述涉及的物质中,原子序数最大的元素是
(2)H、C、O元素的电负性由大到小的顺序为
(3)熔融
 可生成具有挥发性的二聚体,二聚体
可生成具有挥发性的二聚体,二聚体 的结构式为
的结构式为(4)
 的一种晶胞结构如图所示。
的一种晶胞结构如图所示。
①
 属于
属于②下列说法错误的是
A.
 晶体有较高的熔、沸点 B.
晶体有较高的熔、沸点 B. 晶体硬而脆
晶体硬而脆C.
 晶体易溶于水 D.
晶体易溶于水 D. 晶体不导电
晶体不导电③若将
 形成的立方体分割成8个小立方体,则每个小立方体的中心有
形成的立方体分割成8个小立方体,则每个小立方体的中心有 。
。(5)由碳元素形成的某种晶体的晶胞结构如图所示,设阿伏加德罗常数的值为
 ,晶体的密度为
,晶体的密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为 、
、 的代数式表示)pm。
的代数式表示)pm。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】过渡金属铬、铅、镍、铁及其化合物在工业上有重要用途,回答下列问题:
(1)基态Cr原子的价层电子的轨道表示式为_______ 。
(2)氮化铬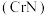 在超级电容器领域具有良好的应用前景,可由
在超级电容器领域具有良好的应用前景,可由 与尿素
与尿素 反应先得到配合物
反应先得到配合物 ,然后在通有
,然后在通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。
①尿素中C、N、O三种元素的第一电离能由大到小的顺序为_______ 。
② 中存在的化学键有
中存在的化学键有_______ (填字母)。
A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示。
的熔点如图所示。 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是_______ 。
②结合 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键中离子键成分的百分数
中的化学键中离子键成分的百分数_______ (填“增大”“减小”或“不变”)。
(4)丁二酮肟常与 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式:_______ 。
(5)某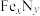 的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物
的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物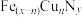 。
。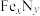 转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为
转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为_______ 。
(1)基态Cr原子的价层电子的轨道表示式为
(2)氮化铬
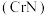 在超级电容器领域具有良好的应用前景,可由
在超级电容器领域具有良好的应用前景,可由 与尿素
与尿素 反应先得到配合物
反应先得到配合物 ,然后在通有
,然后在通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。①尿素中C、N、O三种元素的第一电离能由大到小的顺序为
②
 中存在的化学键有
中存在的化学键有A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅
 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示。
的熔点如图所示。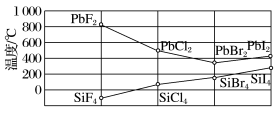
 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是②结合
 的沸点和
的沸点和 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序, 中的化学键中离子键成分的百分数
中的化学键中离子键成分的百分数(4)丁二酮肟常与
 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
(5)某
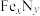 的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物
的晶胞如图1所示。Cu可以完全替代该晶胞中a位置Fe或者b位置Fe,形成Cu替代型产物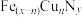 。
。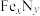 转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为
转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为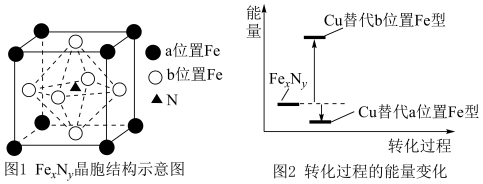
您最近一年使用:0次



