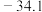名校
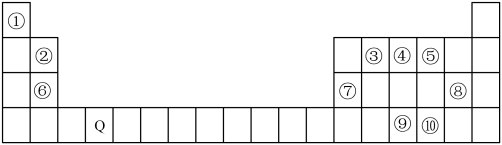
1 . 下表为元素周期表的一部分。请回答下列问题:___________ 区。
(2)比较⑨⑩两种元素的电负性由大到小的顺序___________ ,⑥⑦两种元素的第一电离能由大到小的顺序为___________ (填元素符号)。
(3)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是___________(填序号)。
(4)④和⑤两元素比较,非金属性较弱的是④,可以验证该结论的是下列中的___________ (填序号)。
A.气态氢化物的稳定性
B.两单质在自然界的存在形式
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表④和⑤两元素)
(5)在周期表中,某些电负性相近且处于对角的元素,性质具有相似性,被称为“对角线规则”,如:元素②与元素⑦。元素②的氢氧化物能与强碱反应,写出其离子方程式为___________ 。
(6)原子序数小于36的元素甲和乙,在周期表中既处于同一周期又位于同一族,且原子序数甲比乙多2,甲的基态原子价电子排布式为___________ 。
(2)比较⑨⑩两种元素的电负性由大到小的顺序
(3)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是___________(填序号)。
| A.中心原子的价层电子对数相同 |
| B.中心原子的杂化方式不同 |
| C.分子的VSEPR模型相同,空间结构也相同 |
| D.④与①形成的分子的键角比③与①形成的分子的键角更大 |
(4)④和⑤两元素比较,非金属性较弱的是④,可以验证该结论的是下列中的
A.气态氢化物的稳定性
B.两单质在自然界的存在形式
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表④和⑤两元素)
(5)在周期表中,某些电负性相近且处于对角的元素,性质具有相似性,被称为“对角线规则”,如:元素②与元素⑦。元素②的氢氧化物能与强碱反应,写出其离子方程式为
(6)原子序数小于36的元素甲和乙,在周期表中既处于同一周期又位于同一族,且原子序数甲比乙多2,甲的基态原子价电子排布式为
您最近半年使用:0次
名校
解题方法
2 . 按要求填空:
(1)元素O与Se同主族,电负性O___________ Se(选填“>”、“<”、“=”),基态Se原子价层电子空间运动状态有___________ 种。
(2) 离子的VSEPR模型为
离子的VSEPR模型为___________ ,离子空间构型为___________ 。
(3)6-氨基青霉烷酸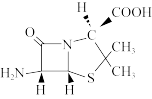 结构中S原子的杂化方式是
结构中S原子的杂化方式是___________ ,组成中C、N、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)1mol环戊二烯(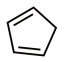 )中含有σ键的数目是
)中含有σ键的数目是___________ ,π键的数目为___________ 。
(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:___________ (填标号)。
(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是___________ ,原因为___________ 。
(7)在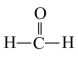 分子中,键角∠HCO
分子中,键角∠HCO___________ (填“>”“<”或“=”)∠HCH,理由是___________ 。
(1)元素O与Se同主族,电负性O
(2)
 离子的VSEPR模型为
离子的VSEPR模型为(3)6-氨基青霉烷酸
 结构中S原子的杂化方式是
结构中S原子的杂化方式是(4)1mol环戊二烯(
 )中含有σ键的数目是
)中含有σ键的数目是(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是
(7)在
 分子中,键角∠HCO
分子中,键角∠HCO
您最近半年使用:0次
3 . 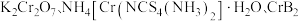 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
; ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为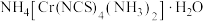 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)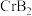 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
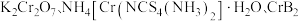 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: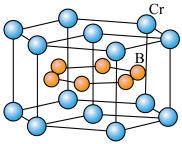
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
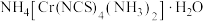 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近半年使用:0次
名校
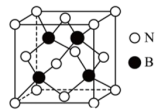
4 . 2023年诺贝尔化学奖授予蒙吉·G·巴文迪等三位科学家,以表彰他们在发现和合成量子点方面所作出的贡献,碳量子点是一类具有显著荧光性能的零维碳纳米材料,其结构如图所示。回答下列问题:_______ 区,图中C的杂化方式为_______ 。
(2)碳量子点结构包含的元素中电负性由大到小排列为:_______ 。
(3)碳量子点水溶性_______ (选填“>”“<”“=”)石墨水溶性,理由是:_______ 。
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有_______ 种,比较二者C-C共价键的键长:石墨_______ 金刚石(选填“>”“<”“=”)。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。_______ ,则立方氮化硼晶体密度为_______ g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。

(2)碳量子点结构包含的元素中电负性由大到小排列为:
(3)碳量子点水溶性
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。
您最近半年使用:0次
名校
解题方法
5 . 硼和氮的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态N原子电子自旋量子数和为___________ ,其价电子中成对电子数与未成对电子数之比是___________ 。
(2)硼烷-吡啶(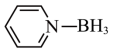 )是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是
)是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是___________ 。硼烷-吡啶组成元素属于第二周期的电负性从大到小的顺序是___________ 。
(3)吡啶( )和吡咯(
)和吡咯( )均含有大
)均含有大 健,相同条件下,熔点吡啶
健,相同条件下,熔点吡啶___________ 吡咯(填“大于”或“小于”),其原因是___________ 。
(4)Ca与B组成的金属硼化物结构如图所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为( ,
, ,
, ),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为
),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为 ___________ ,Ca与 B 原子间的最短距离d=___________ pm(列出计算式即可)。
(1)基态N原子电子自旋量子数和为
(2)硼烷-吡啶(
 )是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是
)是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是(3)吡啶(
 )和吡咯(
)和吡咯( )均含有大
)均含有大 健,相同条件下,熔点吡啶
健,相同条件下,熔点吡啶(4)Ca与B组成的金属硼化物结构如图所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为
 ,
, ,
, ),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为
),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为 
您最近半年使用:0次
名校
解题方法
6 . 过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一、
(1)基态N原子核外能量最高的能级的电子云有___________ 种不同的伸展方向。
(2)锌化铜是一种金属互化物,元素铜的第二电离能大于锌的第二电离能的理由是___________ 。
(3)已知苯酚(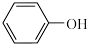 )具有弱酸性,其
)具有弱酸性,其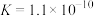 水杨酸第一步电离形成的离子
水杨酸第一步电离形成的离子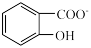 能形成分子内氢键,据此判断,相同温度下电离平衡常数
能形成分子内氢键,据此判断,相同温度下电离平衡常数 (水杨酸)
(水杨酸)___________ K(苯酚)(填“>”或“<”),其原因是___________ 。
(4)下列几种有机羧酸中,按酸性由强到弱的顺序排顺序为___________ (填序号)。
①乙酸( )②氯乙酸(
)②氯乙酸(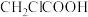 )③三氯乙酸(
)③三氯乙酸( )④三氟乙酸(
)④三氟乙酸( )
)
(5)键角大小比较(填“>”“<”或“=”):①
___________  ②
②
___________  ③
③
___________ 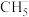 ④
④
___________ 
(6)利用 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成砖红色的
悬浊液检验醛基时,生成砖红色的 ,其晶胞结构如图所示。
,其晶胞结构如图所示。 ,C为
,C为 ,则D原子分数坐标为
,则D原子分数坐标为___________ 。
②若 晶体密度为d g⋅cm
晶体密度为d g⋅cm ,晶胞参数为a pm,则阿伏加德罗常数的值
,晶胞参数为a pm,则阿伏加德罗常数的值 为
为___________ (用含d和a的式子表示)。
(1)基态N原子核外能量最高的能级的电子云有
(2)锌化铜是一种金属互化物,元素铜的第二电离能大于锌的第二电离能的理由是
(3)已知苯酚(
 )具有弱酸性,其
)具有弱酸性,其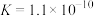 水杨酸第一步电离形成的离子
水杨酸第一步电离形成的离子 能形成分子内氢键,据此判断,相同温度下电离平衡常数
能形成分子内氢键,据此判断,相同温度下电离平衡常数 (水杨酸)
(水杨酸)(4)下列几种有机羧酸中,按酸性由强到弱的顺序排顺序为
①乙酸(
 )②氯乙酸(
)②氯乙酸(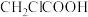 )③三氯乙酸(
)③三氯乙酸( )④三氟乙酸(
)④三氟乙酸( )
)(5)键角大小比较(填“>”“<”或“=”):①

 ②
②
 ③
③
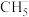 ④
④

(6)利用
 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成砖红色的
悬浊液检验醛基时,生成砖红色的 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
 ,C为
,C为 ,则D原子分数坐标为
,则D原子分数坐标为②若
 晶体密度为d g⋅cm
晶体密度为d g⋅cm ,晶胞参数为a pm,则阿伏加德罗常数的值
,晶胞参数为a pm,则阿伏加德罗常数的值 为
为
您最近半年使用:0次
解题方法
7 . 钛、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态 原子价层电子排布式为
原子价层电子排布式为___________ 。
②基态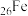 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种。
(2)Ti的四卤化物熔点如下表所示,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
(3)制备 的反应为
的反应为 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为___________ (用元素符号表示)。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为___________ ,中心原子的杂化方式为___________ 。
(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:___________ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是___________ 。
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是___________ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态
 原子价层电子排布式为
原子价层电子排布式为②基态
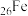 原子核外电子的运动状态有
原子核外电子的运动状态有(2)Ti的四卤化物熔点如下表所示,自
 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |
| 熔点/℃ | -24.12 | 38.3 | 155 |
(3)制备
 的反应为
的反应为 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:
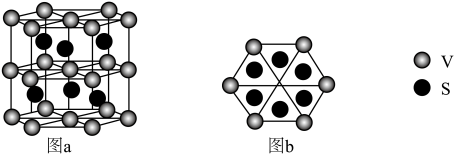
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是
您最近半年使用:0次
名校
解题方法
8 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1) 的价电子排布式为
的价电子排布式为_______ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“_______ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列_______ (填序号),Mn原子的配位数为_______ 。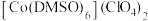 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为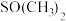 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为_______ ,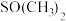 中键角
中键角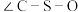
_______  中键角
中键角 (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”), 的中心原子价层电子对数为
的中心原子价层电子对数为_______ ,元素S、Mn、N的电负性由大到小的顺序为_______ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(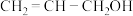 ),该物质与丙醛(
),该物质与丙醛(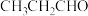 )相比,两者沸点相差较大,原因是
)相比,两者沸点相差较大,原因是_______ 。
(5) 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为_______ 。一定温度下, 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为
,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为_______ g(用含a、NA的代数式表示)。
(1)
 的价电子排布式为
的价电子排布式为(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A. B.
B. C.
C. D.
D.
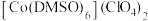 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为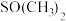 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为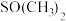 中键角
中键角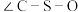
 中键角
中键角 (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”), 的中心原子价层电子对数为
的中心原子价层电子对数为(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(
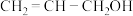 ),该物质与丙醛(
),该物质与丙醛(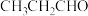 )相比,两者沸点相差较大,原因是
)相比,两者沸点相差较大,原因是(5)
 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为
,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为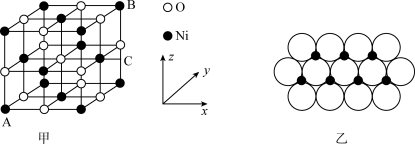
您最近半年使用:0次
2024-04-21更新
|
219次组卷
|
2卷引用:四川省绵阳南山中学2024届高三下学期三诊热身考试理综-化学试题
9 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量做橄榄石矿物( ),回答下列问题:
),回答下列问题:
(1)基态 原子的价电子轨道表示式为
原子的价电子轨道表示式为______________ ,橄榄石中铁的化合价为______ ,橄榄石中,各元素电负性由大到小的顺序为____________
(2)已知一些物质的熔点数据如下表:
Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是____________ 。
(3) 可以形成
可以形成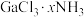 (
( ,4,5,6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,第一次与第二次产生的沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为
,4,5,6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,第一次与第二次产生的沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为_____________ 。
(4)硫酸铜溶液中逐渐滴加氨水至过量,离子反应依次为______________ 、___________ 。再向溶液中加入乙醇能够析出深蓝色的晶体,加入乙醇的作用:_________ 。
(5)某晶体的晶胞结构如图所示,已知晶胞参数分别为 、
、 、
、 ,
, 、
、 原子的坐标分别为
原子的坐标分别为 、
、 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。____________ 。
②C原子的坐标为____________ 。
③该晶体的密度为____________ g/cm3。(列出计算式即可,无需化简)
 ),回答下列问题:
),回答下列问题:(1)基态
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)已知一些物质的熔点数据如下表:
物质 |
|
|
|
|
熔点/℃ |
|
|
|
|
(3)
 可以形成
可以形成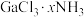 (
( ,4,5,6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,第一次与第二次产生的沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为
,4,5,6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,第一次与第二次产生的沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为(4)硫酸铜溶液中逐渐滴加氨水至过量,离子反应依次为
(5)某晶体的晶胞结构如图所示,已知晶胞参数分别为
 、
、 、
、 ,
, 、
、 原子的坐标分别为
原子的坐标分别为 、
、 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
②C原子的坐标为
③该晶体的密度为
您最近半年使用:0次
名校
10 . 下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题: __________ (用元素符号表示)
(2)④、⑤、⑥的原子半径由大到小的顺序为____________ (用元素符号表示)
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________ (用化学式表示)
(4)铁在元素周期表中的位置________ ,属于________ 区(填“s”、“d”、“ds”或“p”),基态Fe的价层电子排布式为________ ,检验溶液中的 常用
常用 溶液,检验的离子方程式为
溶液,检验的离子方程式为_____________ ,铁氰化钾中四种元素的电负性由大到小的顺序为________ 。
(5)第四周期基态原子未成对电子数最多的元素,其价层电子排布轨道表示式为_________ 。

(2)④、⑤、⑥的原子半径由大到小的顺序为
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(4)铁在元素周期表中的位置
 常用
常用 溶液,检验的离子方程式为
溶液,检验的离子方程式为(5)第四周期基态原子未成对电子数最多的元素,其价层电子排布轨道表示式为
您最近半年使用:0次