名校
解题方法
1 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途
(1)O基态原子核外有___________ 种运动状态的电子,核外电子有___________ 对自旋相反的电子
(2)与O同周期相邻的元素的原子(包括氧),三种元素原子的第一电离能由大到小的顺序为___________ ,氧、硫、硒(Se)三种元素原子的电负性由大到小的顺序为___________ 。
(3)键长:H2Se___________ H2S(填“>”或“<”或“=”,下同),还原性:H2Se___________ H2S;
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是___________ 。
(5)碳是形成化合物种类最多的元素。
①C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是___________ (填字母)。
a. b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
(6)BF3能与NH3反应生成BF3·NH3.BF3·NH3中B原子的杂化轨道类型为___________ ,B与N之间形成___________ 键。硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。[B(OH)4]-中B的空间构型为___________ ,不考虑空间构型,[B(OH)4]-的结构可用示意图表示为___________ 。
(7)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。

该物质结构中,形成配位键的原子中,提供孤对电子的是___________ ,中心原子的配位数是___________ 。
(1)O基态原子核外有
(2)与O同周期相邻的元素的原子(包括氧),三种元素原子的第一电离能由大到小的顺序为
(3)键长:H2Se
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是
(5)碳是形成化合物种类最多的元素。
①C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是
a.
 b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH(6)BF3能与NH3反应生成BF3·NH3.BF3·NH3中B原子的杂化轨道类型为
(7)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示。

该物质结构中,形成配位键的原子中,提供孤对电子的是
您最近一年使用:0次
2 . 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______ 。在第二周期中,第一电离能介于B和N之间的有______ 种元素。
(2)NH3BH3分子中,N—B化学键称为____ 键,其电子对由____ 提供。氨硼烷在催化剂作用下水解释放氢气: 3NH3BH3+6H2O=3NH3+ +9H2,
+9H2, 的结构如图所示:;
的结构如图所示:;
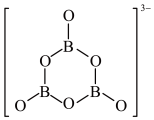
在该反应中,B原子的杂化轨道类型由______ 变为______ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是______ 。与NH3BH3互为等电子体的分子是_____ 。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,N—B化学键称为
 +9H2,
+9H2, 的结构如图所示:;
的结构如图所示:;
在该反应中,B原子的杂化轨道类型由
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
您最近一年使用:0次
名校
解题方法
3 . 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______ 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______ 。
(3)与CN-互为等电子体的一种分子为______ (填化学式);1mol Fe(CN)63-中含有σ键的数目为______ 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______ (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______ 。

(1)Fe2+基态核外电子排布式为
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为
(3)与CN-互为等电子体的一种分子为
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为

您最近一年使用:0次
2018-10-10更新
|
257次组卷
|
5卷引用:2015届四川省大竹县文星中学高三4月月考化学试卷



