名校
解题方法
1 . A、B、C、D、E、F均是短周期元素,其原子序数依次增大,A和B同周期,A和E同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C、D的阳离子电子层结构相同,C与B可生成C2B或C2B2,D的阳离子半径是同周期最小的,F的原子半径是所在周期中最小的。请回答:
(1)E在元素周期表中的位置是_______ 。
(2)C所在周期电负性最强的是_______ ;AB2的结构式是_______ 。
(3)B、C、F的离子半径由大到小的顺序为_______ (用化学式回答,下同);A、D、E元素的最高价氧化物对应水化物中,酸性最强的是_______ 。
(4)B的简单氢化物比H2S沸点高的原因是_______ 。
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:_______ 。
(6)用一个离子方程式证明A、E的非金属性强弱:_______ 。
(1)E在元素周期表中的位置是
(2)C所在周期电负性最强的是
(3)B、C、F的离子半径由大到小的顺序为
(4)B的简单氢化物比H2S沸点高的原因是
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:
(6)用一个离子方程式证明A、E的非金属性强弱:
您最近一年使用:0次
名校
解题方法
2 . 碳元素能形成多种单质及化合物,在生产生活中有重要的研究和应用价值。请根据以下信息,回答下列问题。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。
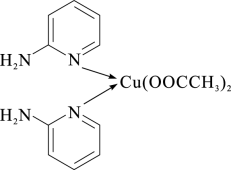
①在元素周期表中铜位于_______ 区(填“s”、“p”、“d”或“ds”)。C、N、O三种元素的电负性由大到小的顺序为_______ 。
②邻氨基吡啶的铜配合物中,Cu2+的配位数是_______ ,N原子的杂化类型有_______ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
①1体积水可溶解约1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_______ ,反应时,向饱和NaCl溶液中先通入_______ 。
②NaHCO3分解得Na2CO3, 空间结构为
空间结构为_______ 。
(3)碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。
①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是_______ 。
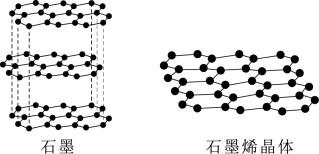
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。
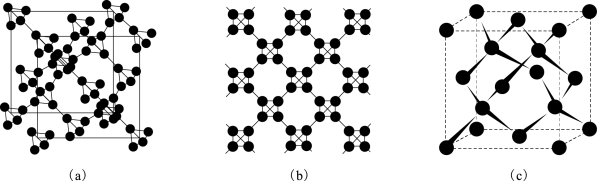
一个T-碳晶胞中含有_______ 个碳原子,T-碳的密度非常小为金刚石的一半,则T-碳晶胞的边长和金刚石晶胞的边长之比为_______ 。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。

①在元素周期表中铜位于
②邻氨基吡啶的铜配合物中,Cu2+的配位数是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
①1体积水可溶解约1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3,
 空间结构为
空间结构为(3)碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。
①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。

一个T-碳晶胞中含有
您最近一年使用:0次
2022-06-26更新
|
377次组卷
|
2卷引用:2024届四川省泸县第五中学高三上学期一诊模拟考试理综试题
3 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(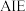 )效应以来,
)效应以来,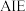 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型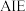 分子
分子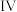 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2)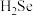 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的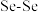 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有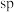 与
与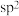
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(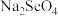 )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。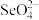 的立体构型为
的立体构型为_______ 。
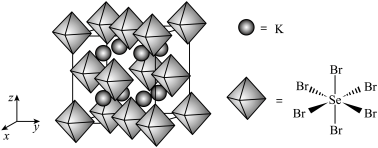
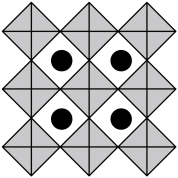
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为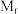 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(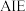 )效应以来,
)效应以来,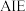 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型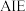 分子
分子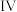 的合成路线如下:
的合成路线如下: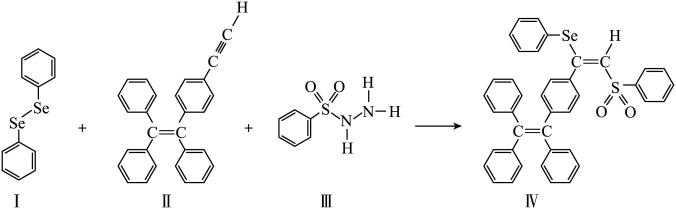
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
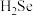 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
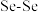 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
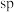 与
与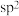
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(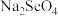 )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。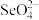 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
②设X的最简式的式量为
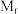 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-06-10更新
|
12643次组卷
|
28卷引用:四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题
四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)T35-物质结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题上海市实验学校2023-2024学年高三上学期第一次月考化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题广东省广州中学2022-2023学年高二下学期期中考试化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题广东省广州市第六十五中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
4 . 硼、碳、氮、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填字母)。
A. B.
B.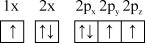
C.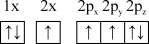 D.
D.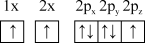
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为___________
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___________ 。其σ键分别为___________ 型σ键。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___________

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___________
(6)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性 (晶体结构如图)。
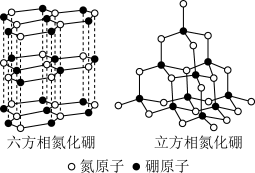
①关于这两种晶体的说法,不正确的是___________ (填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是___________
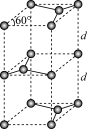
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___________ cm。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.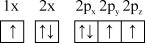
C.
 D.
D.
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 金属阳离子半径/pm | 66 | 99 | 112 | 135 |

①关于这两种晶体的说法,不正确的是
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=

您最近一年使用:0次
2021-05-24更新
|
321次组卷
|
2卷引用:四川省射洪市2021届高考考前模拟测试理综化学试题
名校
5 . 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子价电子排布式为___________ 。
(2)丁二酮肟( )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
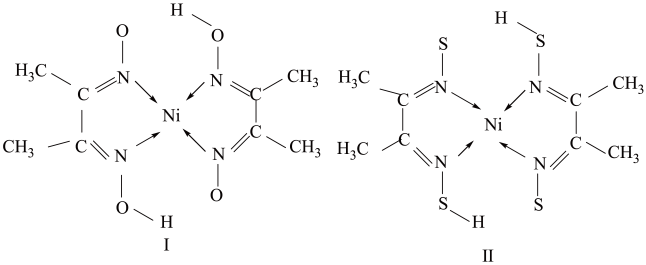
①下列说法正确的有___________ (填字母)。
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是___________ 。
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO 互为等电子体的一种分子
互为等电子体的一种分子___________ 。Fe、Co、Ni三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。
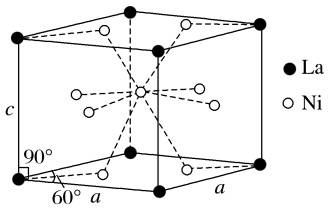
①设该合金的密度为dg/cm3,则该晶胞的体积为___________ cm3(用含 d的代数式表示,NA表示阿伏加德罗常数的值)
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力= 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为___________ (列出最简计算式,计算式不使用小数。NA表示阿伏加德罗常数的值)。
(1)基态镍原子价电子排布式为
(2)丁二酮肟(
 )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
①下列说法正确的有
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO
 互为等电子体的一种分子
互为等电子体的一种分子(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。

①设该合金的密度为dg/cm3,则该晶胞的体积为
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力=
 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
您最近一年使用:0次
6 . 科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______ 。
(2)下列关于CH4和CO2的说法正确的是______ (填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________ ,Ni该元素位于元素周期表的第___ 族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____ molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是______ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________ 。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为
(2)下列关于CH4和CO2的说法正确的是
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
2016-12-09更新
|
1725次组卷
|
3卷引用:2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题



