名校
解题方法
1 . 北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜。”回答下列问题:
(1)基态Cu原子的电子排布式为___________ ; 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态Cu原子核外电子有___________ 个空间运动状态。
(2)胆矾的化学式为CuSO4●5H2O, 其中SO 的空间构型为
的空间构型为___________
(3)Cu2+能与乙二胺四乙酸根阴离子 形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是___________ ,第一电离能最大的是___________ ;C、N原子的轨道杂化类型分别为___________ 、___________ 。
(4)某种合金的晶胞结构如图所示,晶体中K原子的配位数为___________ ;已知金属原子半径r(Na)和r(K),计算晶体的空间利用率: ___________ (假设原子是刚性球体)。(用代数式表示)

(1)基态Cu原子的电子排布式为
(2)胆矾的化学式为CuSO4●5H2O, 其中SO
 的空间构型为
的空间构型为(3)Cu2+能与乙二胺四乙酸根阴离子
 形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是(4)某种合金的晶胞结构如图所示,晶体中K原子的配位数为

您最近一年使用:0次
2021-10-14更新
|
435次组卷
|
2卷引用:四川省内江市第六中学2021-2022年高三上学期第二次月考化学试题
名校
解题方法
2 . N、P、As均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________ (填序号,下同),未成对电子最多的是___________ 。
a. ls22s22p3 b.1s22s2 c.1s22s12p4 d.1s22s12p3
(2)Si、P与S是同周期中相邻的元素,Si、 P、S的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(3)吡啶为含N有机物。这类物质是合成医药农药的重要原料。下列吡啶类化合物A与Zn(CH3CH2)2(即ZnEt2 )反应生成有机化合物B, B具有优异的催化性能。
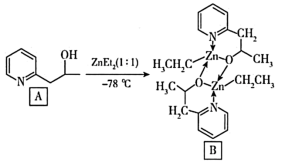
吡啶类化合物A中N原子的杂化类型是___________ ,化合物A易溶于水,原因是___________ ,含Zn有机物B的分子结构中含___________ (填序号)。
A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(4)N与金属可形成氮化物,如AIN的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。

①AIN晶胞中,含有的Al、N原子个数均是___________ 。
②若该氮化铁的晶胞边长为apm,阿伏加德罗常数的值为NA,则该氮化铁晶体的密度可表示为___________ 。 g·cm-3.若该氮化铁的化学式为FexNy,Cu可替代晶胞中不同位置的Fe,形成Cu替代型的化学式是Fex-nCunNy,而FexNy转化为两种Cu替代型产物的能量变化如图丙所示,Cu替代晶胞中的Fe形成化学式为FeCu3N的氮化物不稳定,则a位置表示晶胞中的___________ (填“顶点"或“面心”)。
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a. ls22s22p3 b.1s22s2 c.1s22s12p4 d.1s22s12p3
(2)Si、P与S是同周期中相邻的元素,Si、 P、S的电负性由大到小的顺序是
(3)吡啶为含N有机物。这类物质是合成医药农药的重要原料。下列吡啶类化合物A与Zn(CH3CH2)2(即ZnEt2 )反应生成有机化合物B, B具有优异的催化性能。

吡啶类化合物A中N原子的杂化类型是
A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(4)N与金属可形成氮化物,如AIN的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。

①AIN晶胞中,含有的Al、N原子个数均是
②若该氮化铁的晶胞边长为apm,阿伏加德罗常数的值为NA,则该氮化铁晶体的密度可表示为
您最近一年使用:0次
2021-06-15更新
|
390次组卷
|
4卷引用:天一大联考“顶尖计划”2021届高三第一次考试化学试题
名校
解题方法
3 . 2017年4月26日,中国首艘国产航母在大连正式下水,标志着我国自主设计建造航空母舰取得重大阶段性成果。请回答下列问题:
I、航母用钢可由低硅生铁冶炼而成。
(1)硅原子价层电子的轨道表示式(电子排布图)为_____________ 。
(2)Fe3+比Fe2+稳定的原因是____________ 。
(3)FeO、NiO的晶体结构与NaCl的晶体结构相同。其中Fe2+与Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm。则熔点FeO________ (填“<”“>”或“=”)NiO,原因是___________________ 。
II、航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
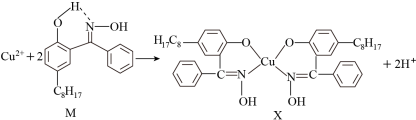
(4)M所含元素的电负性由大到小的顺序为_________________________ (用元素符号表示)。
(5)上述反应中断裂和生成的化学键有________ (填序号)。
A.共价键 B.配位键 C.金属键 D.范德华力
(6)航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图所示。

①该晶胞结构中铜原子的配位数是________ 。
②已知该晶体的密度为dg∙cm-3,阿加德罗常数的值为NA,则该立方晶胞的参数是________________ pm。
I、航母用钢可由低硅生铁冶炼而成。
(1)硅原子价层电子的轨道表示式(电子排布图)为
(2)Fe3+比Fe2+稳定的原因是
(3)FeO、NiO的晶体结构与NaCl的晶体结构相同。其中Fe2+与Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm。则熔点FeO
II、航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

(4)M所含元素的电负性由大到小的顺序为
(5)上述反应中断裂和生成的化学键有
A.共价键 B.配位键 C.金属键 D.范德华力
(6)航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图所示。

①该晶胞结构中铜原子的配位数是
②已知该晶体的密度为dg∙cm-3,阿加德罗常数的值为NA,则该立方晶胞的参数是
您最近一年使用:0次
名校
解题方法
4 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图。 的价电子排布式为
的价电子排布式为_______ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是_______ 。
(2)甘氨酸(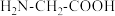 )中N的杂化轨道类型为
)中N的杂化轨道类型为_______ ;甘氨酸易溶于水,试从结构角度解释_______ 。
(3)一水合甘氨酸锌中 的配位数为
的配位数为_______ 。 填入
填入 组成
组成_______ 空隙中;
②由①能否判断出 、
、 相切?
相切?_______ (填“能”或“否”);
③已知晶体密度为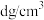 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为_______ pm(写计算表达式)。
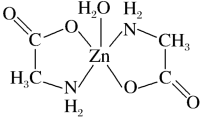
 的价电子排布式为
的价电子排布式为(2)甘氨酸(
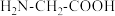 )中N的杂化轨道类型为
)中N的杂化轨道类型为(3)一水合甘氨酸锌中
 的配位数为
的配位数为(4) 是
是 的另一种配合物,IMI的结构为
的另一种配合物,IMI的结构为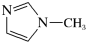 ,常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态。原因是
为液态而非固态。原因是
 填入
填入 组成
组成②由①能否判断出
 、
、 相切?
相切?③已知晶体密度为
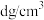 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为
您最近一年使用:0次
2021-01-03更新
|
379次组卷
|
6卷引用:四川省成都市2020届高三第一次诊断性检测理综化学试题
解题方法
5 . 铁、钴均为第四周期VIII族元素,它们的单质及化合物具有广泛用途。回答下列问题:
(1)基态Co2+中成单电子数为___________ ;Fe和Co的第三电离能I3(Fe)___________ I3(Co)(填“>”“<”或“=”)。
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:

①EDTA中电负性最大的元素是___________ ,其中C原子轨道杂化类型为___________ ;
②EDTA存在的化学键有___________ (填序号)。
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1 mol CoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1 mol AgCl沉淀。则CoCl3·4NH3中配离子的化学式为___________ ;已知孤电子对与成键电子的排斥作用大于成键电子对与成键电子的排斥作用,试判断NH3分子与钴离子形成配合物后H-N-H键角___________ (填“变大”、“变小”或“不变”)。
(4)一种铁氮化合物具有高磁导率,其结构如图所示:
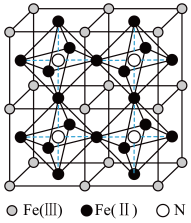
已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA
①该结构中单纯分析铁的堆积,其堆积方式为___________ ;
②该铁氮化合物的化学式为___________ ;
③计算Fe(II)构成正八面体的体积为___________ cm3
(1)基态Co2+中成单电子数为
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:

①EDTA中电负性最大的元素是
②EDTA存在的化学键有
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1 mol CoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1 mol AgCl沉淀。则CoCl3·4NH3中配离子的化学式为
(4)一种铁氮化合物具有高磁导率,其结构如图所示:

已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA
①该结构中单纯分析铁的堆积,其堆积方式为
②该铁氮化合物的化学式为
③计算Fe(II)构成正八面体的体积为
您最近一年使用:0次
2020-12-29更新
|
1082次组卷
|
7卷引用:四川省成都市2021届高三第一次诊断性考试理综试卷化学试题
四川省成都市2021届高三第一次诊断性考试理综试卷化学试题(已下线)大题09 物质结构与性质(二)(选修)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅱ卷)(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅰ卷)(已下线)重点10 物质结构与性质综合题-2021年高考化学专练【热点·重点·难点】(已下线)学科网2021年高三1月大联考考后强化卷(新课标Ⅲ卷)(已下线)02 物质结构与性质综合题型集训(2) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解题方法
6 . 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6
(1)颜料中含有Cu元素,基态Cu原子的价电子排布式为___________ ;Si、O、Ba元素电负性由大到小的顺序为_____ ,干冰、Si、SiC熔点由高到低的顺序为_____________ 。
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配位化合物,其中提供孤电子对的是_______ 元素。
(3)铜可作CH3CH2OH氧化生成CH3CHO的催化剂。乙醇的沸点高于乙醛,其主要原因是_____________________________ 。
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式________________ ;C、N、O的第一电离能由大到小的顺序为__________________________________ 。
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。
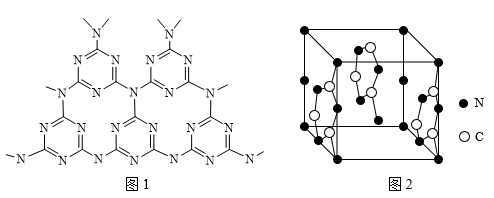
ⅰ.g-C3N4中氮原子的杂化类型是___________________ 。
ⅱ.根据图2,在图1中用平行四边形画出一个最小重复单元_____________ 。
ⅲ.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g- C3N4的密度为___________________ 。
(1)颜料中含有Cu元素,基态Cu原子的价电子排布式为
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配位化合物,其中提供孤电子对的是
(3)铜可作CH3CH2OH氧化生成CH3CHO的催化剂。乙醇的沸点高于乙醛,其主要原因是
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。

ⅰ.g-C3N4中氮原子的杂化类型是
ⅱ.根据图2,在图1中用平行四边形画出一个最小重复单元
ⅲ.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g- C3N4的密度为
您最近一年使用:0次
解题方法
7 . Ni元素在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Ni原子价层电子的排布式为__ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行__ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是__ ;(SCN)2分子中,硫原子的杂化方式是__ ,σ键和π键数目之比为__ 。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为__ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键 e.共价键
(5)镍合金储氢的研究已取得很大进展。

①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金可吸附H2的数目为__ 。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的__ (填“八面体空隙”或“四面体空隙”)。若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为___ nm(用含d、M、NA的代数式表示)。
(1)基态Ni原子价层电子的排布式为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为
a.离子键 b.金属键 c.配位键 d.氢键 e.共价键
(5)镍合金储氢的研究已取得很大进展。

①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金可吸附H2的数目为
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的
您最近一年使用:0次
名校
解题方法
8 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
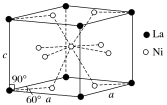
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:四川省内江市2017届高三第五次模拟考试理综化学试题
四川省内江市2017届高三第五次模拟考试理综化学试题四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题2016届河北省晋州一中高三上学期期末理综化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2016届湖北省襄阳五中高三5月模拟三理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题苏教版2017届高三单元精练检测十一化学试题湖北省孝感市八校2018届高三上学期期末考试理综化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
名校
解题方法
9 . 科学家预测21 世纪中叶将进入“氢能经济”时代,许多化合物或合金都是具有广阔应用前景的储氢材料。回答下列问题:
(1)基态Li原子核外电子有___ 种不同的运动状态,占据最高能层电子的电子云轮廓图形状为____________ 。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为___________________ 。
(3)亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是_________ 。
(4)咔唑(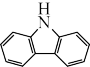 )的沸点比芴(
)的沸点比芴( 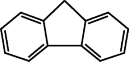 )高的主要原因是
)高的主要原因是___________________ 。
(5)NH3BH3(氨硼烷,熔点104℃)与______ (写出一种分子)互为等电子体。可通过红外光谱测定该分子的立体构型,NH3BH3中B的杂化轨道类型为____________ 。
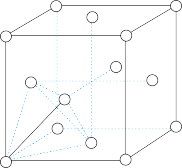
(6)一种储氢合金的晶胞结构如图所示。在晶胞中Cu 原子处于面心,Au 原子处于顶点位置。该晶体中,原子之间的作用力是___________ 。实现储氢功能时,氢原子可进入到由Cu 原子与Au 原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为__________ 。已知该晶胞的晶胞参数为a nm,阿伏加 德罗常数值为NA,则密度ρ为__________ g/cm3(用NA和a的代数式表示)
(1)基态Li原子核外电子有
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为
(3)亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是
(4)咔唑(
 )的沸点比芴(
)的沸点比芴(  )高的主要原因是
)高的主要原因是(5)NH3BH3(氨硼烷,熔点104℃)与
(6)一种储氢合金的晶胞结构如图所示。在晶胞中Cu 原子处于面心,Au 原子处于顶点位置。该晶体中,原子之间的作用力是

您最近一年使用:0次
名校
解题方法
10 . 铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1) 铜元素在元素周期表中的位置为______ ,基态Cu原子核外有______ 种不同运动状态的电子。
(2) 铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如图反应实现铜离子的富集回收。
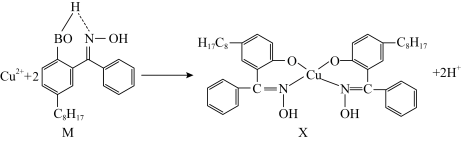
① M所含元素的电负性由大到小的顺序为________ (用元素符号表示)。
② X中采用sp3杂化的非金属原子有_____________ (填元素名称)。
(3) 在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是_____ ,Y的沸点比水低的主要原因是______ 。Fe的价电子排布式为_____ 。
(4) 向蓝色[Cu(H2O)4]2+硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。通过上述实验现象可知,与Cu2+的配位能力:H2O____ NH3(填“大于”或“小于”)。
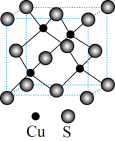
(5) CuS与ZnS的晶胞相似,结构如图所示。CuS晶胞中与硫原子距离最近且相等的硫原子有12个,若CuS晶胞的密度为ρ g·cm-3,用NA代表阿伏加 德罗常数的值,则晶胞边长为________ nm。
(1) 铜元素在元素周期表中的位置为
(2) 铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如图反应实现铜离子的富集回收。

① M所含元素的电负性由大到小的顺序为
② X中采用sp3杂化的非金属原子有
(3) 在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是
(4) 向蓝色[Cu(H2O)4]2+硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。通过上述实验现象可知,与Cu2+的配位能力:H2O
(5) CuS与ZnS的晶胞相似,结构如图所示。CuS晶胞中与硫原子距离最近且相等的硫原子有12个,若CuS晶胞的密度为ρ g·cm-3,用NA代表阿伏加 德罗常数的值,则晶胞边长为

您最近一年使用:0次



