N、P、As均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________ (填序号,下同),未成对电子最多的是___________ 。
a. ls22s22p3 b.1s22s2 c.1s22s12p4 d.1s22s12p3
(2)Si、P与S是同周期中相邻的元素,Si、 P、S的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(3)吡啶为含N有机物。这类物质是合成医药农药的重要原料。下列吡啶类化合物A与Zn(CH3CH2)2(即ZnEt2 )反应生成有机化合物B, B具有优异的催化性能。
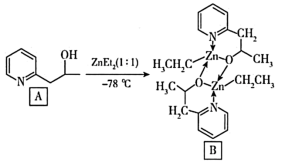
吡啶类化合物A中N原子的杂化类型是___________ ,化合物A易溶于水,原因是___________ ,含Zn有机物B的分子结构中含___________ (填序号)。
A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(4)N与金属可形成氮化物,如AIN的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。

①AIN晶胞中,含有的Al、N原子个数均是___________ 。
②若该氮化铁的晶胞边长为apm,阿伏加德罗常数的值为NA,则该氮化铁晶体的密度可表示为___________ 。 g·cm-3.若该氮化铁的化学式为FexNy,Cu可替代晶胞中不同位置的Fe,形成Cu替代型的化学式是Fex-nCunNy,而FexNy转化为两种Cu替代型产物的能量变化如图丙所示,Cu替代晶胞中的Fe形成化学式为FeCu3N的氮化物不稳定,则a位置表示晶胞中的___________ (填“顶点"或“面心”)。
(1)下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a. ls22s22p3 b.1s22s2 c.1s22s12p4 d.1s22s12p3
(2)Si、P与S是同周期中相邻的元素,Si、 P、S的电负性由大到小的顺序是
(3)吡啶为含N有机物。这类物质是合成医药农药的重要原料。下列吡啶类化合物A与Zn(CH3CH2)2(即ZnEt2 )反应生成有机化合物B, B具有优异的催化性能。

吡啶类化合物A中N原子的杂化类型是
A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(4)N与金属可形成氮化物,如AIN的晶胞结构如图甲所示,某种氮化铁的结构如图乙所示。

①AIN晶胞中,含有的Al、N原子个数均是
②若该氮化铁的晶胞边长为apm,阿伏加德罗常数的值为NA,则该氮化铁晶体的密度可表示为
更新时间:2021-06-15 22:30:48
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】Cu的单质和合金在生活、生产中有着广泛的应用。回答下列问题:
(1)Cu的基态原子价电子排布式为___ 。
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___ ,反应的化学方程式为___ 。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___ ,该配离子的空间构型为___ ;CN-中配位原子是___ (填名称)。
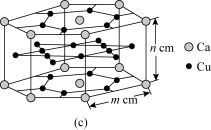
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有___ 个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___ pm,设NA为阿伏加 德罗常数的值,CaCu晶体的密度是___ g/cm3(用含m、n的式子表示)。


(1)Cu的基态原子价电子排布式为
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
(3)配离子Cu(CN)32-中,中心离子的杂化类型是
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有
②同一层中,Ca原子之间的最短距离是



您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的价电子排布式为___________ ,位于周期表___________ 区。
(2)生产农药的原料 中P、S、
中P、S、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 分子的立体构型为
分子的立体构型为___________ 。
(4)如图为 的结构,S原子的杂化轨道类型为
的结构,S原子的杂化轨道类型为___________ ,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___ 。

(5)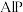 因杀虫效率高、廉价易得而被广泛应用。已知
因杀虫效率高、廉价易得而被广泛应用。已知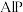 的熔点为2000℃,其晶胞结构如图所示。
的熔点为2000℃,其晶胞结构如图所示。
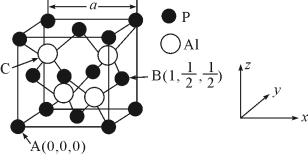
①磷化铝的晶体类型为___ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为___ 。
③磷化铝的晶胞参数 ,其密度为
,其密度为___  (列出计算式即可,用
(列出计算式即可,用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)基态砷原子的价电子排布式为
(2)生产农药的原料
 中P、S、
中P、S、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 分子的立体构型为
分子的立体构型为(4)如图为
 的结构,S原子的杂化轨道类型为
的结构,S原子的杂化轨道类型为
(5)
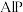 因杀虫效率高、廉价易得而被广泛应用。已知
因杀虫效率高、廉价易得而被广泛应用。已知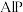 的熔点为2000℃,其晶胞结构如图所示。
的熔点为2000℃,其晶胞结构如图所示。
①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数
 ,其密度为
,其密度为 (列出计算式即可,用
(列出计算式即可,用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】W、X、Y、Z、Q五种元素的原子结构与性质如表所示,其中前四种是常见的短周期主族元素。回答下列问题:
(1)W在元素周期表中的位置为___________ ,写出其基态原子的轨道表示式___________ 。
(2) 与足量的
与足量的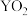 的水溶液发生反应生成两种强酸,该反应的化学方程式为
的水溶液发生反应生成两种强酸,该反应的化学方程式为___________ 。将足量单质X通入含有2mol 溶液中充分反应,转移电子的数目为
溶液中充分反应,转移电子的数目为___________ ( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(3)与Q同周期的元素的基态原子中,最外层电子数与Q原子相同的元素有哪些?___________
(4)将W、X、Y、Z的简单离子,按照微粒半径由小到大的顺序排列___________ (用元素符号表示)
(5)关于元素Z的判断,正确的是___________
(6)Z元素的一种相邻元素,其基态原子的轨道表示式是下图中的___________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合___________ (填字母)。

A.能量最低原理 B.泡利原理 C.洪特规则 D.构造原理
(7)对于基态Q原子,下列叙述正确的是___________。
(8)阅读以下核电荷数为21-25的元素的最高正化合价,回答下列问题:
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
| 元素编号 | 元素的性质与原子结构 |
| W | 基态原子有5个原子轨道填充有电子,有3个未成对电子 |
| X | 最外层电子数为奇数的第三周期元素,其气态氢化物遇W的气态氢化物产生大量白烟 |
| Y | 基态原子有16个不同运动状态的电子 |
| Z | 周期数=族序数,简单离子最外层电子数为8 |
| Q | 基态原子在前四周期中未成对电子数最多 |
(2)
 与足量的
与足量的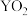 的水溶液发生反应生成两种强酸,该反应的化学方程式为
的水溶液发生反应生成两种强酸,该反应的化学方程式为 溶液中充分反应,转移电子的数目为
溶液中充分反应,转移电子的数目为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(3)与Q同周期的元素的基态原子中,最外层电子数与Q原子相同的元素有哪些?
(4)将W、X、Y、Z的简单离子,按照微粒半径由小到大的顺序排列
(5)关于元素Z的判断,正确的是___________
| A.Z元素的焰色反应为黄色 |
| B.Z元素最高价氧化物对应水化物为强碱 |
| C.Z元素的第一电离能高于同周期左右相邻元素 |
| D.Z元素在失去第三个电子之后,电离能发生突变 |

A.能量最低原理 B.泡利原理 C.洪特规则 D.构造原理
(7)对于基态Q原子,下列叙述正确的是___________。
| A.因为轨道处于半充满时体系总能量低,所以Q核外电子排布结果中未成对电子数最多。 |
| B.因为4s电子能量较高,一定在比3s电子离核更远的地方运动 |
| C.Q电负性比钾高,原子对键合电子的吸引力比钾大 |
| D.Q的价电子排布与钾原子相同 |
| 元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
| 元素符号 | Sc | Ti | V | Cr | Mn |
| 核电荷数 | 21 | 22 | 23 | 24 | 25 |
| 最高正价 | +3 | +4 | +5 | +6 | +7 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
①表中碱性最强的为_______ (写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______ ;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
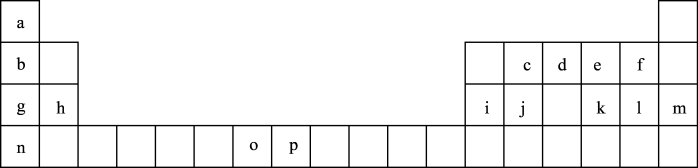
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
①推测SiO2晶胞中Si采用______ 杂化,O—Si—O的键角为___________ 。
②一个SiO2晶胞中,含有_______ 个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______ Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏加 德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。

试回答下列问题:
①表中碱性最强的为
②基态o原子的价电子排布图为
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。

①推测SiO2晶胞中Si采用
②一个SiO2晶胞中,含有
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石
④假设金刚石晶胞的边长为a pm,NA为阿伏加 德罗常数,试计算该晶胞的密度
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】硼氢化钠(NaBHa)中氢元素为-1价,具有很强的还原性,被称为“万能还原剂”。回答下列问题:
(1)基态硼原子的电子排布图是____ ,其原子核外共有____ 种运动状态的电子。
(2)硼与铍相比,第一电离能较高的是____ ,原因是____ 。
(3)NaBH4中所含的化学键的类型有____ ,[BH4]-的空间构型是____ ,其中心原子的杂化轨道类型为____ 。
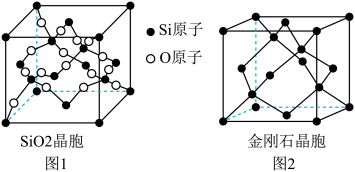
(4)硼氢化钠(NaBH4)的晶胞结构及晶胞参数如图所示:
①Na+的配位数是____ 。
②若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为____ 。
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为____ g•cm-3(用含a、NA的式子表示)。
(1)基态硼原子的电子排布图是
(2)硼与铍相比,第一电离能较高的是
(3)NaBH4中所含的化学键的类型有
(4)硼氢化钠(NaBH4)的晶胞结构及晶胞参数如图所示:

①Na+的配位数是
②若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氮族元素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)As原子的价电子的轨道表示式为_______ ,同周期中与其具有相同未成对电子数的元素还有_______ 种。如图表示碳、硅和磷元素的四级电离变化趋势,其中表示碳元素的曲线是_______ (填标号)。
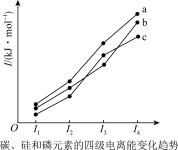
(2)含有氨基物质的碱性随着N原子电子云密度的增大而增强,则NH3、CH3NH2、NH2OH的碱性由强到弱的顺序为_______ 。
(3)配合物甘氨酸亚铁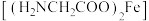 的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为
的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为_______ ,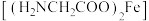 中σ键与π键的个数比为
中σ键与π键的个数比为_______ 。
(4)气态 PCl5空间构型为三角双锥,结构如图1,其中心原子的杂化类型为_______ (填符号),
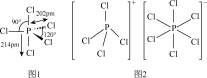
a. b.
b. c.
c.
PCl5的二溴代物PCl3Br2的结构有_______ 种;固态PCl5中含有正四面体形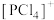 和正八面体形的
和正八面体形的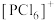 如图2,而固态PBr5却含有
如图2,而固态PBr5却含有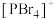 和Br-,不能形成
和Br-,不能形成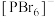 的原因是
的原因是_______ 。
(1)As原子的价电子的轨道表示式为

(2)含有氨基物质的碱性随着N原子电子云密度的增大而增强,则NH3、CH3NH2、NH2OH的碱性由强到弱的顺序为
(3)配合物甘氨酸亚铁
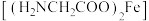 的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为
的主要生理功能是预防和改善缺铁性贫血,中心离子的配位数是4,则配位原子为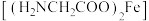 中σ键与π键的个数比为
中σ键与π键的个数比为(4)气态 PCl5空间构型为三角双锥,结构如图1,其中心原子的杂化类型为

a.
 b.
b. c.
c.
PCl5的二溴代物PCl3Br2的结构有
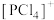 和正八面体形的
和正八面体形的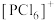 如图2,而固态PBr5却含有
如图2,而固态PBr5却含有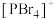 和Br-,不能形成
和Br-,不能形成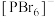 的原因是
的原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】如图是元素①~⑥在元素周期表中的位置。
(1)①的原子结构示意图是_______ ,②形成单质的电子式是_______ 。
(2)③在周期表中的位置是_______ 。①和③可以形成化合物,请用电子式表示该化合物形成的过程_______ 。
(3)③、④、⑤、⑥形成的简单离子中,半径最小的是_______ (填离子符号)。
(4)非金属性:②_______ ③(填“>”或“<”),从原子结构角度解释其原因_______ 。
(5)⑤最高价氧化物的水化物可以与⑥的单质反应,请写出反应的离子方程式_______ 。
(6)下列关于①的说法正确的是_______ 。
a.在同主族元素中,①最高价氧化物的水化物的碱性最强
b.①在空气中加热生成的产物是过氧化物
c.①可以与水反应生成氢气
(7)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
x的范围是_______ 。请根据以上数据推测,在目前已知的118种元素中,电负性最大的元素为_______ (填元素符号)。
| ① | ② | ③ | ④ | ||||
| ⑤ | ⑥ | ||||||
(2)③在周期表中的位置是
(3)③、④、⑤、⑥形成的简单离子中,半径最小的是
(4)非金属性:②
(5)⑤最高价氧化物的水化物可以与⑥的单质反应,请写出反应的离子方程式
(6)下列关于①的说法正确的是
a.在同主族元素中,①最高价氧化物的水化物的碱性最强
b.①在空气中加热生成的产物是过氧化物
c.①可以与水反应生成氢气
(7)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 | 铝 | 硅 | 磷 | 硫 | 氯 |
| 电负性 | 1.5 | 1.8 | 2.1 | x | 3.0 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义.通过下列反应可以制备某电池正极的活性物质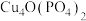 .
.
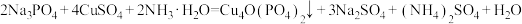
请回答下列问题:
(1)上述反应中涉及的N、O、P元素电负性由小到大的顺序是_____________ .
(2)基态 原子的价电子排布式为
原子的价电子排布式为_____________ .
(3)上述制备所得固体最后用乙醇洗涤的目的是____________ .
(4) 的立体构型为
的立体构型为__________ ,其中Р原子的杂化方式是____________ .
(5)在硫酸铜溶液中加入过量 溶液,生成配合物
溶液,生成配合物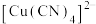 ,则
,则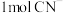 中含有的
中含有的 键数目为
键数目为______ , 中含有的
中含有的 键数目为
键数目为_____________ .
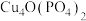 .
.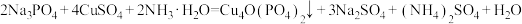
请回答下列问题:
(1)上述反应中涉及的N、O、P元素电负性由小到大的顺序是
(2)基态
 原子的价电子排布式为
原子的价电子排布式为(3)上述制备所得固体最后用乙醇洗涤的目的是
(4)
 的立体构型为
的立体构型为(5)在硫酸铜溶液中加入过量
 溶液,生成配合物
溶液,生成配合物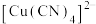 ,则
,则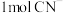 中含有的
中含有的 键数目为
键数目为 中含有的
中含有的 键数目为
键数目为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___ (填元素符号)。
(2)b单质分子中σ键与π键的个数比为___ 。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___ ;这两种物质的互溶物中,存在的化学键有___ (填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___ (填化学式,下同);酸根呈正三角形结构的酸是___ ,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___ 酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___ 区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为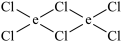 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键___ 。
回答下列问题:
(1)b、c、d电负性最大的是
(2)b单质分子中σ键与π键的个数比为
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是
(5)元素e在周期表中的位置是
 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铜及其合金广泛应用于生活生产。如黄铜合金可作首饰、镀层等。请回答下列问题:
(1)基态铜原子价层电子排布式为___________ 。
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
①NO 中N原子的杂化类型是
中N原子的杂化类型是___________ ;NH3分子的立体构型是___________ 。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有___________ 个未成对电子;1mol该阳离子含有的σ键的数目为___________ 。
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是___________ 。
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

已知:晶胞参数为anm。
①合金中粒子间作用力类型是___________ ,与Cu原子等距离且最近的Cu原子有___________ 个。
②黄铜合金晶体密度为___________ g·cm-3(设NA为阿伏加德罗常数的数值,用含字母a和NA的式子表示)。
(1)基态铜原子价层电子排布式为
(2)在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
①NO
 中N原子的杂化类型是
中N原子的杂化类型是②[Cu(NH3)4]2+中提供孤对电子的基态原子有
③NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
(3)黄铜合金采取面心立方堆积,其晶胞结构如图所示:

已知:晶胞参数为anm。
①合金中粒子间作用力类型是
②黄铜合金晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】用 /
/ 电催化剂作为锌—空气电池正极材料,调控了碳纤维膜的孔隙结构和Fe单原子催化点位的配位环境,实现了氧还原/氧析出双功能催化活性。请回答下列问题:
电催化剂作为锌—空气电池正极材料,调控了碳纤维膜的孔隙结构和Fe单原子催化点位的配位环境,实现了氧还原/氧析出双功能催化活性。请回答下列问题:
(1)Zn原子核外电子有___________ 种运动状态,基态Fe原子有___________ 个未成对电子。
(2)C、N、S分别与H形成的简单氢化物中键角最小的是___________ ,其原因是___________ 。
(3)H、C、N、S四种元素可形成硫氰酸( )和异硫氰酸(
)和异硫氰酸( ),异硫氰酸分子中σ键与π键的数目比为
),异硫氰酸分子中σ键与π键的数目比为___________ ,异硫氰酸沸点较高,原因是___________ 。
(4)铁和氮在一定条件下反应生成Fe4N,Fe4N的晶胞结构如图所示,N原子的配位数是___________ 。若两个最近的Fe原子间的距离为a pm,则该晶体密度为___________  (阿伏加德罗常数的数值用NA表示)。
(阿伏加德罗常数的数值用NA表示)。

 /
/ 电催化剂作为锌—空气电池正极材料,调控了碳纤维膜的孔隙结构和Fe单原子催化点位的配位环境,实现了氧还原/氧析出双功能催化活性。请回答下列问题:
电催化剂作为锌—空气电池正极材料,调控了碳纤维膜的孔隙结构和Fe单原子催化点位的配位环境,实现了氧还原/氧析出双功能催化活性。请回答下列问题:(1)Zn原子核外电子有
(2)C、N、S分别与H形成的简单氢化物中键角最小的是
(3)H、C、N、S四种元素可形成硫氰酸(
 )和异硫氰酸(
)和异硫氰酸( ),异硫氰酸分子中σ键与π键的数目比为
),异硫氰酸分子中σ键与π键的数目比为(4)铁和氮在一定条件下反应生成Fe4N,Fe4N的晶胞结构如图所示,N原子的配位数是
 (阿伏加德罗常数的数值用NA表示)。
(阿伏加德罗常数的数值用NA表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Fe与Si形成的合金及铁的配合物用途非常广泛,回答下列问题:
(1)基态Fe2+核外价电子排布式为________ ;在基态Si原子中,核外存在_____ 对自旋方向相反的电子。
(2)Fe78Si9B13是一种非晶合金,可通过________ 方法区分晶体和非晶体。
(3)硅烯是一种具有石墨烯结构的新型二维材料,二硅烯Si2H4分子的几何构型为____ ,依据电子云的重叠方式可知其所含共价键类型是________ 。
(4)配合物[Fe(Htrz)3](ClO4) 2 (Htrz为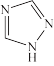 ,1,2,4-三氮唑)
,1,2,4-三氮唑)
①与Fe2+形成配位键的原子是_______ ;已知分子中的大 键可用
键可用 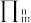 符号表示,其中m代表参与形成大
符号表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则配体
键的电子数,则配体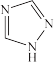 中的大
中的大 键应表示为
键应表示为_____
②1,2,4-三氮唑的沸点为260 ℃,环戊二烯( )的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是
)的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
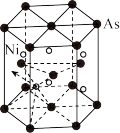
(5)砷化镍晶胞的结构如下图所示,1个砷化镍晶胞中含________ 个As;若六棱柱底边边长为a cm,高为c cm,阿伏加德罗数的值为NA,则砷化镍的密度为____ g/cm3。
(1)基态Fe2+核外价电子排布式为
(2)Fe78Si9B13是一种非晶合金,可通过
(3)硅烯是一种具有石墨烯结构的新型二维材料,二硅烯Si2H4分子的几何构型为
(4)配合物[Fe(Htrz)3](ClO4) 2 (Htrz为
 ,1,2,4-三氮唑)
,1,2,4-三氮唑)①与Fe2+形成配位键的原子是
 键可用
键可用 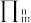 符号表示,其中m代表参与形成大
符号表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则配体
键的电子数,则配体 中的大
中的大 键应表示为
键应表示为②1,2,4-三氮唑的沸点为260 ℃,环戊二烯(
 )的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是
)的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是(5)砷化镍晶胞的结构如下图所示,1个砷化镍晶胞中含

您最近一年使用:0次



