解题方法
1 . 工业上制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3,请回答下列问题:
(1)上述反应体系中出现的几种短周期元素中,第二周期元素电负性由大到小的顺序是_____ 。
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于气态有机物的电子式是_____ ,该分子为_____ (填“极性”或“非极性”)分子;
(3)PH3分子与NH3分子结构相似PH3相对分子质量大于NH3,但NH3沸点高于PH3,其原因是:_____ ;
(4)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式[Mn(CO)5(CH3CN)],
①Mn原子的配位数为_____ ;
②CH3CN中C原子的杂化类型为:_____ ;
③CH3CN中σ键与π键数目之比为:_____ ;
(5)化合物FeF3熔点高于1000°C而Fe(CO)5的熔点却低于0°C,FeF3熔点远高于Fe(CO)5的原因可能是_____ ;
(6)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O;
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为_____ ;
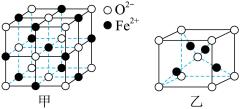
②Cu2O立方晶胞结构如图乙所示,若晶胞参数为apm,则该晶体的密度为_____ g/cm3(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)。
(1)上述反应体系中出现的几种短周期元素中,第二周期元素电负性由大到小的顺序是
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于气态有机物的电子式是
(3)PH3分子与NH3分子结构相似PH3相对分子质量大于NH3,但NH3沸点高于PH3,其原因是:
(4)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式[Mn(CO)5(CH3CN)],
①Mn原子的配位数为
②CH3CN中C原子的杂化类型为:
③CH3CN中σ键与π键数目之比为:
(5)化合物FeF3熔点高于1000°C而Fe(CO)5的熔点却低于0°C,FeF3熔点远高于Fe(CO)5的原因可能是
(6)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O;
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为

②Cu2O立方晶胞结构如图乙所示,若晶胞参数为apm,则该晶体的密度为
您最近一年使用:0次
2023-06-21更新
|
143次组卷
|
2卷引用:四川省成都市新都区2022-2023学年高三上学期期末摸底测试理科综合化学试题
名校
2 . 决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
元素M化合态常见化合价是___________ 价,其基态原子电子排布式为___________ 。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是___________ 。
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为___________ 。
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为___________ 。但NF3不易与Cu2+形成化学键,其原因是___________ 。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为___________ 。
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为___________ 个,二者的最短距离为___________ pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为___________ g·cm-3。
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
2019-03-27更新
|
686次组卷
|
2卷引用:四川省泸县第二中学2020届高三上学期期末考试理综化学试题
名校
解题方法
3 . 电镀工业上,为了提高镀锌的效果,通常采用Zn(CN)42-溶液代替Zn2+溶液进行电解。请回答下列问题:
(1)元素锌在周期表中的位置为_____________ ,基态Zn的价电子排布式为_____________ 。
(2)Zn(CN) 42-所含元素中,电负性最大的元素是_____________ ,Zn(CN) 42-中含有的化学键类型有σ键和_____________ 。
(3)CN-中C的杂化类型为_____________ ,与CN-互为等电子体的单质为_____________ 。
(4)H2CO3与HNO3的酸性相差较大,请解释其原因_____________ 。
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为_____________ ,其晶体结构如图,已知晶胞边长为apm,则AlN的密度为_____________ (用含a、NA的代数式表示)g/cm3。
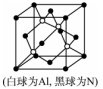
(1)元素锌在周期表中的位置为
(2)Zn(CN) 42-所含元素中,电负性最大的元素是
(3)CN-中C的杂化类型为
(4)H2CO3与HNO3的酸性相差较大,请解释其原因
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为

您最近一年使用:0次
2019-01-13更新
|
479次组卷
|
2卷引用:四川省泸县第一中学2020届高三上学期期末考试理综化学试题
解题方法
4 . 镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________ ,未成对电子数为________________ 。
(2)Ga(NO3)3中阴离子的立体构型是_____________ ,写出一个与该阴离子的立体构型相同的分子的化学式___________ 。
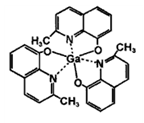
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________ (填元素符号),提供孤电子对的成键原子是_____________ 。
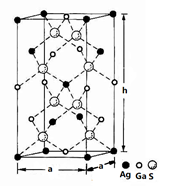
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________ ,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________ g·cm-3(列出计算式即可)。
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为
(2)Ga(NO3)3中阴离子的立体构型是
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是

(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为

您最近一年使用:0次
2018-04-28更新
|
347次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2020届高三上学期期末考试理综化学试题
名校
解题方法
5 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____ 区元素,其基态原子的价电子排布式为_____ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为____ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____ (用元素符号表示)。
(4)CO32-的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________ ,1mol碳酸丙烯酯中键的数目为________ .
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____ ,该配离子包含的作用力为__ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏伽德罗常数的值为NA,则Na与O之间的最短距离为_____ cm(用含ρ、NA的代数式表示)。
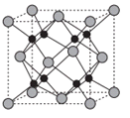
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为
(4)CO32-的几何构型为

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
2018-04-27更新
|
459次组卷
|
5卷引用:四川省棠湖中学2020届高三上学期期末考试理综化学试题
名校
解题方法
6 . [化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为_____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为____________ ,已知该晶体的密度为ρg/cm3,NA是阿伏伽德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
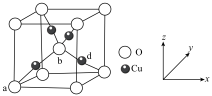
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为
(2)MgO的熔点高于CuO的原因是
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为

您最近一年使用:0次
2018-01-12更新
|
552次组卷
|
4卷引用:四川省宜宾市第四中学校2020届高三上学期期末考试理综化学试题



