电镀工业上,为了提高镀锌的效果,通常采用Zn(CN)42-溶液代替Zn2+溶液进行电解。请回答下列问题:
(1)元素锌在周期表中的位置为_____________ ,基态Zn的价电子排布式为_____________ 。
(2)Zn(CN) 42-所含元素中,电负性最大的元素是_____________ ,Zn(CN) 42-中含有的化学键类型有σ键和_____________ 。
(3)CN-中C的杂化类型为_____________ ,与CN-互为等电子体的单质为_____________ 。
(4)H2CO3与HNO3的酸性相差较大,请解释其原因_____________ 。
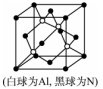
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为_____________ ,其晶体结构如图,已知晶胞边长为apm,则AlN的密度为_____________ (用含a、NA的代数式表示)g/cm3。
(1)元素锌在周期表中的位置为
(2)Zn(CN) 42-所含元素中,电负性最大的元素是
(3)CN-中C的杂化类型为
(4)H2CO3与HNO3的酸性相差较大,请解释其原因
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为

更新时间:2019-01-13 13:01:17
|
相似题推荐
【推荐1】N、Cu等元素的化合物在工农业生产中有着广泛的应用。
(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为___ 。
(2) 存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为
存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为___ ;___ 。
(3)基态Cu2+价电子的空间运动状态有___ 种。
(4)Cu元素与Br元素形成的化合物的晶胞结构如图所示,该晶胞沿z轴在平面的投影图中,Cu原子构成的几何图形是___ ,若晶胞的密度为dg·cm-3,则Cu原子与Br原子之间的最短距离为___ μm(列出计算式即可,NA表示阿伏加德罗常数的值)。

(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为
A.1s22s22p 2p 2p 2p 2p | B.1s22s22p 2p 2p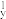 3s1 3s1 |
C.1s22s22p 2p 2p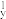 | D.1s22s22p 3s1 3s1 |
 存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为
存在两种分子内氢键,若用“…表示其氢键”,则其分子结构分别为(3)基态Cu2+价电子的空间运动状态有
(4)Cu元素与Br元素形成的化合物的晶胞结构如图所示,该晶胞沿z轴在平面的投影图中,Cu原子构成的几何图形是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】硫化锶(SrS)可用作发光材料、光谱纯试剂和燃料添加剂。工业上可用碳热还原法制备SrS,相关反应及信息如下表所示:
回答下列问题:
(1)Sr与Ca同族且相邻。基态Sr原子的电子排布式为___________ 。
(2)反应Ⅰ、Ⅱ、Ⅲ中,自发进行所需温度最高的是___________ (填反应序号)。
(3)将1 mol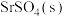 和3 mol
和3 mol 加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示:
加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示: ℃时容器内几乎不发生反应Ⅲ的原因为
℃时容器内几乎不发生反应Ⅲ的原因为___________ 。
②若 ℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
___________ (用含t的代数式表示)。
③温度高于 ℃时,容器内发生主要反应的热化学方程式为
℃时,容器内发生主要反应的热化学方程式为___________ 。
④ ℃时,反应Ⅰ的平衡常数
℃时,反应Ⅰ的平衡常数
___________ ( 是用平衡浓度表示的平衡常数)。
是用平衡浓度表示的平衡常数)。
⑤M、N点对应状态下继续反应一段时间,其平均反应速率 :M
:M___________ N(填“>”“<”或“=”),理由为___________ 。
(4)若起始以物质的量之比为1∶1向密闭容器中加入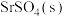 和
和 发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高
发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高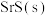 平衡产量的是
平衡产量的是___________ (填选项字母)。
A.适当升高温度 B.适当增大压强 C.使用更高效的催化剂
| 反应 | 焓变 /kJ·mol /kJ·mol | 熵变 /kJ·mol /kJ·mol ·K ·K |
Ⅰ. | +189.1 | 0.37 |
Ⅱ. | +534.0 | 0.72 |
Ⅲ.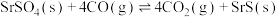 | -155.8 | 0.015 |
(1)Sr与Ca同族且相邻。基态Sr原子的电子排布式为
(2)反应Ⅰ、Ⅱ、Ⅲ中,自发进行所需温度最高的是
(3)将1 mol
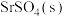 和3 mol
和3 mol 加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示:
加入10 L恒容密闭容器中制备SrS,实验测得平衡体系中各成分的物质的量分数与温度的关系如图所示:
 ℃时容器内几乎不发生反应Ⅲ的原因为
℃时容器内几乎不发生反应Ⅲ的原因为②若
 ℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
℃时,从反应开始到恰好达到平衡的时间为t min,则0~t min内,反应的平均速率
③温度高于
 ℃时,容器内发生主要反应的热化学方程式为
℃时,容器内发生主要反应的热化学方程式为④
 ℃时,反应Ⅰ的平衡常数
℃时,反应Ⅰ的平衡常数
 是用平衡浓度表示的平衡常数)。
是用平衡浓度表示的平衡常数)。⑤M、N点对应状态下继续反应一段时间,其平均反应速率
 :M
:M(4)若起始以物质的量之比为1∶1向密闭容器中加入
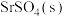 和
和 发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高
发生反应,达到平衡后,其他条件不变,改变下列条件,有利于提高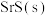 平衡产量的是
平衡产量的是A.适当升高温度 B.适当增大压强 C.使用更高效的催化剂
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】硫酸锰广泛用于基肥、拌种、食品加工和无机化工生产。以硬锰矿(组成为 ,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
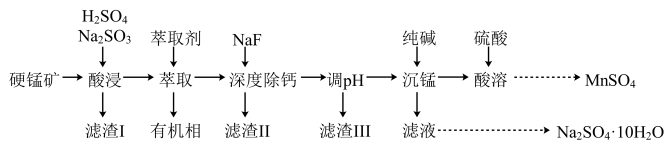
已知: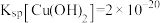 、
、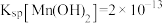 、-
、- 。
。
(1)Mn2+的价电子排布式为___________ ,“酸浸”时MnO2溶解反应的化学方程式为___________ 。
(2)“萃取”时发生的反应: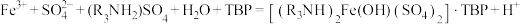 ,Fe3+的萃取率与溶液pH的关系如图所示。当pH=
,Fe3+的萃取率与溶液pH的关系如图所示。当pH= 时Fe3+萃取率最大的原因为
时Fe3+萃取率最大的原因为___________ 。

(3)若省去“深度除钙”工序,会导致的后果为___________ 。
(4)若要使“调pH”后所得滤液中
 、
、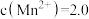
 ,则“调pH”的合理范围为
,则“调pH”的合理范围为___________ 。
(5)“沉锰”所得滤液经处理后得到Na2SO4溶液,由该溶液制备芒硝( )的操作为
)的操作为___________ (硫酸钠的溶解度随温度的变化如图所示)。

(6)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为 ,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320
,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320 KMnO4溶液滴定(
KMnO4溶液滴定( 被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数
被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数___________ 。(写计算过程,保留两位有效数字)
 ,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
,含少量SiO2和Cu、Fe、Ca化合物杂质)为原料制备MnSO4的一种工艺流程如图所示:
已知:
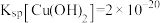 、
、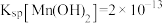 、-
、- 。
。(1)Mn2+的价电子排布式为
(2)“萃取”时发生的反应:
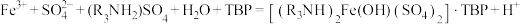 ,Fe3+的萃取率与溶液pH的关系如图所示。当pH=
,Fe3+的萃取率与溶液pH的关系如图所示。当pH= 时Fe3+萃取率最大的原因为
时Fe3+萃取率最大的原因为
(3)若省去“深度除钙”工序,会导致的后果为
(4)若要使“调pH”后所得滤液中

 、
、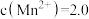
 ,则“调pH”的合理范围为
,则“调pH”的合理范围为(5)“沉锰”所得滤液经处理后得到Na2SO4溶液,由该溶液制备芒硝(
 )的操作为
)的操作为
(6)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为
 ,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320
,过滤;向滤液中加入Na2C2O4固体0.5360g,振荡,充分溶解并反应后,用0.0320 KMnO4溶液滴定(
KMnO4溶液滴定( 被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数
被还原为Mn2+),用去20.00mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。计算产品中MnSO4的质量分数
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】纳米磷化钴(CoP)常用于制作特种钴玻璃,制备磷化钴的常用流程如图:
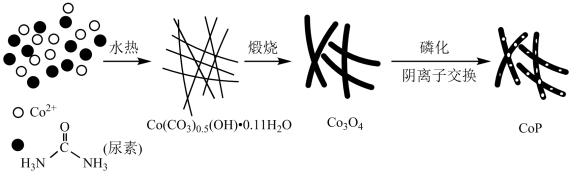
(1)基态Co2+离子的价电子排布式为____ 。
(2)尿素中C原子的杂化类型是____ ;C、N、O三种元素的第一电离能最大的是____ (填元素符号,下空同),电负性由小到大的顺序为____ 。
(3)Co(CO3)0.5(OH)•0.11H2O中CO 中C的价层电子对数为
中C的价层电子对数为____ ;该化合物中含有的化学键有____ (填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.非极性键
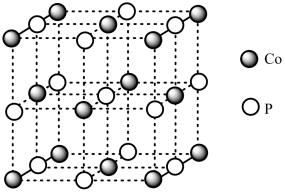
(4)CoP的晶胞结构如图所示,最近且相邻两个钴原子的距离为npm。设NA为阿伏加德罗常数的值,则其晶胞密度为____ g•cm-3(列出计算式即可)。

(1)基态Co2+离子的价电子排布式为
(2)尿素中C原子的杂化类型是
(3)Co(CO3)0.5(OH)•0.11H2O中CO
 中C的价层电子对数为
中C的价层电子对数为A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.非极性键
(4)CoP的晶胞结构如图所示,最近且相邻两个钴原子的距离为npm。设NA为阿伏加德罗常数的值,则其晶胞密度为

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A________ 、B________ 、C________ 、D________ (填元素符号)
(2)电负性:B______ D (填“>”、“=”或“<”); E的离子结构示意图为____________ 。
(3)写出C元素基态原子的价电子排布图:__________________________ 。
(4)由这五种元素组成的一种化合物水溶液显酸性,请用离子方程式表示其原因:________________
(1)A
(2)电负性:B
(3)写出C元素基态原子的价电子排布图:
(4)由这五种元素组成的一种化合物水溶液显酸性,请用离子方程式表示其原因:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】在新型冠状病毒疫情中常用84消毒液进行消毒,有效成分为NaClO溶液,其主要是基于次氯酸(HClO)的氧化性。氯所在的卤族元素在生产生活中有广泛应用,回答以下问题:
(1)基态氯原子的核外价电子排布式为__________ ,HClO分子中中心原子的杂化轨道类型为__________ 。
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为_________ 。
(3)①与Cl相邻的元素S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为__________ 。
②硫和氧形成的链状化合物结构如图(C),其化学式为__________ 。
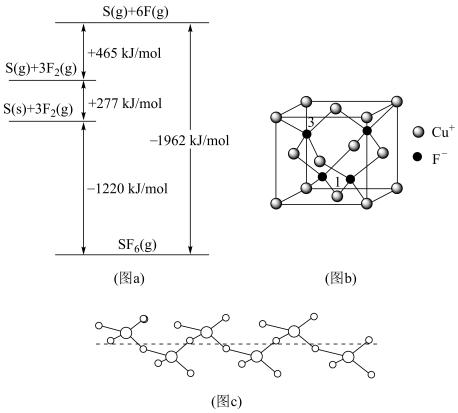
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是_________ 。
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为__________ ,写出一种与配体互为等电子体的阳离子的电子式__________ 。
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为________ 。用Mg·mol-1表示CuF的摩尔质量,NA表示阿伏加 德罗常数的值,则CuF晶体的密度为______ g·cm-3。
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为( ,
, ,0),则离子3的坐标为
,0),则离子3的坐标为__________ 。
(1)基态氯原子的核外价电子排布式为
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为
(3)①与Cl相邻的元素S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为
②硫和氧形成的链状化合物结构如图(C),其化学式为

(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为(
 ,
, ,0),则离子3的坐标为
,0),则离子3的坐标为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】下表为长式周期表的一部分其中的编号代表对应的元素。
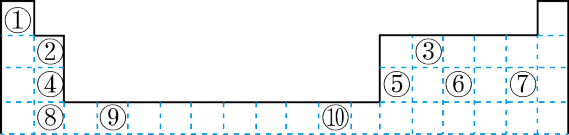
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】某化学工作者研究在不同 时,
时, 溶液对
溶液对 分解的催化作用。
分解的催化作用。
已知:a. 为红色固体,难溶于水,溶于硫酸生成
为红色固体,难溶于水,溶于硫酸生成 和
和 。
。
b.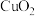 为棕褐色固体,难溶于水,溶于硫酸生成
为棕褐色固体,难溶于水,溶于硫酸生成 和
和 。
。
c. 为弱酸性。
为弱酸性。
请回答下列有关问题:
(1)写出 的电离方程式
的电离方程式_______ ;写出 的电子式
的电子式_______ ; 中
中 原子的杂化类型是
原子的杂化类型是_______ 。
(2)经检验生成的气体均为 ,Ⅰ中
,Ⅰ中 催化分解
催化分解 的化学方程式是
的化学方程式是_______ 。
(3)要检验某铜粉是否含 ,写出具体操作、现象及结论
,写出具体操作、现象及结论_______ 。
(4)取适量Ⅲ中洗涤干净的棕褐色沉淀于试管中,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。据此,_______ (填“能”或“否”)判断该棕色沉淀中没有 ;理由是
;理由是_______ 。
(5)结合离子方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因:_______ 。
 时,
时, 溶液对
溶液对 分解的催化作用。
分解的催化作用。| 编号 | 实验 | 现象 |
| Ⅰ | 向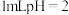 的 的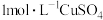 溶液中加入 溶液中加入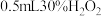 溶液 溶液 | 出现少量气泡 |
| Ⅱ | 向 的 的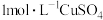 溶液中加入 溶液中加入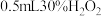 溶液 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
| Ⅲ | 向 的 的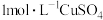 溶液中加入 溶液中加入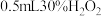 溶液 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
 为红色固体,难溶于水,溶于硫酸生成
为红色固体,难溶于水,溶于硫酸生成 和
和 。
。b.
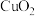 为棕褐色固体,难溶于水,溶于硫酸生成
为棕褐色固体,难溶于水,溶于硫酸生成 和
和 。
。c.
 为弱酸性。
为弱酸性。请回答下列有关问题:
(1)写出
 的电离方程式
的电离方程式 的电子式
的电子式 中
中 原子的杂化类型是
原子的杂化类型是(2)经检验生成的气体均为
 ,Ⅰ中
,Ⅰ中 催化分解
催化分解 的化学方程式是
的化学方程式是(3)要检验某铜粉是否含
 ,写出具体操作、现象及结论
,写出具体操作、现象及结论(4)取适量Ⅲ中洗涤干净的棕褐色沉淀于试管中,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。据此,
 ;理由是
;理由是(5)结合离子方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】回答下列问题:
(1)已知五种气体的溶解度如下表(气体的压强为 ,温度为
,温度为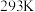 )。
)。
①比较电负性大小:S_______ P(填“>”“<”或“=”),硫化氢溶解度大于磷化氢可能原因是_______ 。
②已知不同杂化方式的碳原子的电负性会有差异,请从以上信息排出电负性的正确顺序:
_______ 
_______  ,乙烷、乙烯、乙炔中最易与金属钠反应的物质是
,乙烷、乙烯、乙炔中最易与金属钠反应的物质是_______ 。
(2)镍原子形成的微粒,电子排布式分别为① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,有关这些微粒的叙述,下列叙述正确的是_______。
,有关这些微粒的叙述,下列叙述正确的是_______。
(3)铜及其化合物具有广泛的应用。请回答:
① 元素位于周期表
元素位于周期表_______ 区。
②下列说法不正确的是_______ 。
A.基态铜原子的核外电子有29种不间的空间运动状态
B.铜催化烯烃硝化反应时会产生 的键角比
的键角比 大
大
C. 中非金属元素电负性:
中非金属元素电负性:
D.配位键的强度: 大于
大于
③高温下固体中 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是_______ 。[已知:金属阳离子在水溶液中易与水分子发生络合形成水合离子,对应的热效应称为水合能, 的水合能为
的水合能为 的水合能为
的水合能为 的第二电离能为
的第二电离能为 。]
。]
④ 与S形成的某化合物晶体的晶胞如图,该化合物的化学式为
与S形成的某化合物晶体的晶胞如图,该化合物的化学式为_______ 。该晶胞形状为长方体,长为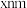 ,宽为
,宽为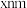 ,高为
,高为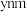 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
(1)已知五种气体的溶解度如下表(气体的压强为
 ,温度为
,温度为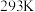 )。
)。| 气体 | 乙烷 | 乙烯 | 乙炔 | 硫化氢 | 磷化氢 |
溶解度 | 0.0062 | 0.0149 | 0.117 | 0.36 | 0.036 |
②已知不同杂化方式的碳原子的电负性会有差异,请从以上信息排出电负性的正确顺序:


 ,乙烷、乙烯、乙炔中最易与金属钠反应的物质是
,乙烷、乙烯、乙炔中最易与金属钠反应的物质是(2)镍原子形成的微粒,电子排布式分别为①
 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,有关这些微粒的叙述,下列叙述正确的是_______。
,有关这些微粒的叙述,下列叙述正确的是_______。A.微粒半径: | B.由光谱仪一定可以捕捉到发射光谱的是:②③④ |
C.电离一个电子所需最低能量: | D.得电子能力: |
①
 元素位于周期表
元素位于周期表②下列说法不正确的是
A.基态铜原子的核外电子有29种不间的空间运动状态
B.铜催化烯烃硝化反应时会产生
 的键角比
的键角比 大
大C.
 中非金属元素电负性:
中非金属元素电负性:
D.配位键的强度:
 大于
大于
③高温下固体中
 比
比 稳定,常温下水溶液中
稳定,常温下水溶液中 离子比
离子比 离子稳定(水溶液中
离子稳定(水溶液中 易发生歧化反应生成
易发生歧化反应生成 ),原因是
),原因是 的水合能为
的水合能为 的水合能为
的水合能为 的第二电离能为
的第二电离能为 。]
。]④
 与S形成的某化合物晶体的晶胞如图,该化合物的化学式为
与S形成的某化合物晶体的晶胞如图,该化合物的化学式为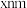 ,宽为
,宽为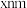 ,高为
,高为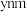 ,阿伏加德罗常数为
,阿伏加德罗常数为 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】利用铁矿石(Fe2O3),可以制得Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)基态Fe3+的价电子排布式为___________ 。
(2)O、S、C三种元素的电负性由大到小的顺序为___________ ,Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃。Fe(CO)5晶体类型是___________ 。
(3)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的分子为___________ (任写一种),SCN-中碳原子的杂化类型为___________ 。第一电离能I1(N)___________ I1(O)(填“大于”、“小于”或“等于”),理由是___________ 。
(4)钾晶体(其晶胞结构如图所示)的晶胞参数为apm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为___________ pm,晶体钾的密度计算式是___________ g/m3(设NA为阿伏伽德罗常数的值)

(1)基态Fe3+的价电子排布式为
(2)O、S、C三种元素的电负性由大到小的顺序为
(3)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的分子为
(4)钾晶体(其晶胞结构如图所示)的晶胞参数为apm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为

您最近一年使用:0次
【推荐2】VA族元素氮、磷、砷(As)、锑(Sb)、铋(Bi)的单质及其化合物在科研和生产中有许多重要用途。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的价电子排布式为_______ 。
(2)第三周期元素中第一电离能大于磷的元素有_______ (填元素符号)。
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是_______ (填“顺式”或“反式”)。

(4)氨硼烷(BH3▪NH3)是一种储氢材料,与乙烷互为等电子体,熔点为104℃。氨硼烷晶体中各种微粒间的作用力涉及________ (填标号)。
A.范德华力 B.离子键 C.配位键 D.金属键
(5)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,可杀死各种草本植物,其阴离子的立体构型为___ 。
(6)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H44+,其结构式为_______ ,其中N原子的杂化方式为________ 。
(7)镧、铁、锑三种元素组成的一种固体能实现热电效应。该固体晶胞结构如图l所示,晶胞参数为a nm,Fe原子填在6个Sb原子形成的正八面体空隙中,晶胞6个表面的结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图l中原子甲的坐标为(0,0,0),原子乙的坐标为( ,
, ,0),则原子丙的坐标为
,0),则原子丙的坐标为________ 。
②设阿伏加 德罗常数的值为NA,则该固体的密度ρ=__ g·cm-3(列出计算式即可)。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。铋的价电子排布式为
(2)第三周期元素中第一电离能大于磷的元素有
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是

(4)氨硼烷(BH3▪NH3)是一种储氢材料,与乙烷互为等电子体,熔点为104℃。氨硼烷晶体中各种微粒间的作用力涉及
A.范德华力 B.离子键 C.配位键 D.金属键
(5)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,可杀死各种草本植物,其阴离子的立体构型为
(6)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H44+,其结构式为
(7)镧、铁、锑三种元素组成的一种固体能实现热电效应。该固体晶胞结构如图l所示,晶胞参数为a nm,Fe原子填在6个Sb原子形成的正八面体空隙中,晶胞6个表面的结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图l中原子甲的坐标为(0,0,0),原子乙的坐标为(
 ,
, ,0),则原子丙的坐标为
,0),则原子丙的坐标为②设阿伏加 德罗常数的值为NA,则该固体的密度ρ=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】铜是常见的、用途广泛的金属元素之一。
(1)基态Cu原子核外未成对电子所在的原子轨道是_______ 。
(2)一价铜离子配合物的结构如图所示:
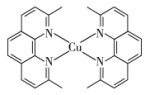
①上述配合物中 (Ⅰ)的配位数是
(Ⅰ)的配位数是_______ 。
②上述配合物分子中碳原子的杂化方式为_______ 。
③上述配合物中所含元素电负性由大到小的顺序为_______ (用元素符号表示)。
(3)常见的铜的氧化物有CuO和 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是 。
。
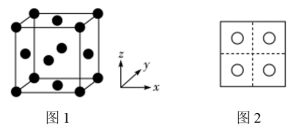
①CuO晶胞中,铜离子的坐标参数是 、
、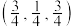 、
、_______ 和_______ 。
② 晶体的密度是
晶体的密度是_______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态Cu原子核外未成对电子所在的原子轨道是
(2)一价铜离子配合物的结构如图所示:

①上述配合物中
 (Ⅰ)的配位数是
(Ⅰ)的配位数是②上述配合物分子中碳原子的杂化方式为
③上述配合物中所含元素电负性由大到小的顺序为
(3)常见的铜的氧化物有CuO和
 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是 。
。
①CuO晶胞中,铜离子的坐标参数是
 、
、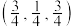 、
、②
 晶体的密度是
晶体的密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



