解题方法
1 . 钛是一种银白色过渡金属,在高科技社会中得到了广泛的应用。可以从钛铁矿( )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。
(1)基态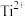 的价电子排布式为
的价电子排布式为___________ ,其核外能量最高的电子所在的能层符号为___________ ,其核外共有___________ 种运动状态不同的电子。
(2)Ti的配合物有多种。在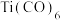 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是___________ (填写元素名称), 中
中
___________ (填“大于”、“小于”或“等于”)单个水分子中 ,原因是
,原因是___________ 。
(3) 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是___________ ,N原子的杂化方式为___________ ,与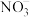 互为等电子体的分子为
互为等电子体的分子为___________ (写分子式)。 和
和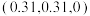 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为___________ ;若阿伏加德罗常数的值为 ,金红石的密度为
,金红石的密度为___________  (列出计算表达式)。
(列出计算表达式)。
 )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。(1)基态
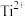 的价电子排布式为
的价电子排布式为(2)Ti的配合物有多种。在
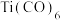 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是 中
中
 ,原因是
,原因是(3)
 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是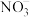 互为等电子体的分子为
互为等电子体的分子为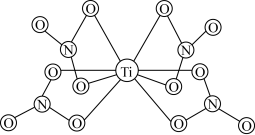
 和
和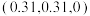 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为 ,金红石的密度为
,金红石的密度为 (列出计算表达式)。
(列出计算表达式)。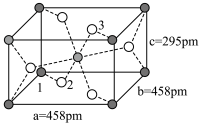
您最近一年使用:0次
名校
2 . 固体电解质以其在电池、传感器等装置中的广泛应用而备受关注,大致分为无机物类及高分子类。
(1)固体电解质中研究得最多的是 和O等的导体。
和O等的导体。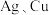 在元素周期表中位于同一族且
在元素周期表中位于同一族且 在
在 的下一周期,具有类似的价层电子排布式,
的下一周期,具有类似的价层电子排布式, 的价层电子排布式为
的价层电子排布式为___________ 。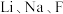 和O的电负性从小到大的顺序为
和O的电负性从小到大的顺序为___________ 。F的第二电离能___________ O的第二电离能(填“>”或“=”或“<”)。
(2) 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(3)1979年,法国Armand等报道了聚氧化乙烯( )碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的
)碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的___________ 杂化轨道与C的 杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为
杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为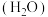
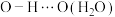 ,请写出使聚氧化乙烯具有水溶性的氢键的表示式
,请写出使聚氧化乙烯具有水溶性的氢键的表示式___________ 。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如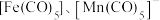 等都满足这个规则。钒配合物
等都满足这个规则。钒配合物 的熔点为
的熔点为 ,其晶体类型为:
,其晶体类型为:___________ ;已知该化合物满足18电子规则,其配体“ ”中的大
”中的大 键可表示为
键可表示为___________ 。(已知苯中的大 键表示为:
键表示为: )
)
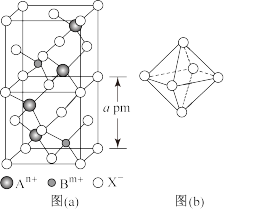
(5)图(a)为一种由阳离子 和阴离子
和阴离子 组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为___________ ,
___________ 。 堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为
堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为___________ ,占有率为___________ 。图(b)为 堆积形成的正八面体,其边长为
堆积形成的正八面体,其边长为___________  。(用含a的式子表示)
。(用含a的式子表示)
(1)固体电解质中研究得最多的是
 和O等的导体。
和O等的导体。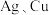 在元素周期表中位于同一族且
在元素周期表中位于同一族且 在
在 的下一周期,具有类似的价层电子排布式,
的下一周期,具有类似的价层电子排布式, 的价层电子排布式为
的价层电子排布式为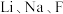 和O的电负性从小到大的顺序为
和O的电负性从小到大的顺序为(2)
 中阴离子的空间构型为
中阴离子的空间构型为(3)1979年,法国Armand等报道了聚氧化乙烯(
 )碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的
)碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的 杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为
杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为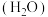
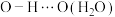 ,请写出使聚氧化乙烯具有水溶性的氢键的表示式
,请写出使聚氧化乙烯具有水溶性的氢键的表示式(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如
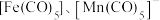 等都满足这个规则。钒配合物
等都满足这个规则。钒配合物 的熔点为
的熔点为 ,其晶体类型为:
,其晶体类型为: ”中的大
”中的大 键可表示为
键可表示为 键表示为:
键表示为: )
)(5)图(a)为一种由阳离子
 和阴离子
和阴离子 组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
 堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为
堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为 堆积形成的正八面体,其边长为
堆积形成的正八面体,其边长为 。(用含a的式子表示)
。(用含a的式子表示)
您最近一年使用:0次
名校
3 . 锂电池的电解液是目前研究的热点。
(1)锂电池的电解液可采用溶有 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。
①基态 的电子云轮廓图的形状为
的电子云轮廓图的形状为_______ 。
②基态P原子的价层电子轨道表示式为_______ 。
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为 。
。_______ 。
②该阳离子中,带“*”的C原子的杂化轨道类型为_______ 杂化。
③根据VSEPR模型, 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为正八面体形。
(3) 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。_______ (填“ ”或“
”或“ ”)。
”)。
②距离 最近的
最近的 有
有_______ 个。
③已知 的摩尔质量是
的摩尔质量是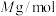 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
(1)锂电池的电解液可采用溶有
 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。①基态
 的电子云轮廓图的形状为
的电子云轮廓图的形状为②基态P原子的价层电子轨道表示式为
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为
 。
。
②该阳离子中,带“*”的C原子的杂化轨道类型为
③根据VSEPR模型,
 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。
 ”或“
”或“ ”)。
”)。②距离
 最近的
最近的 有
有③已知
 的摩尔质量是
的摩尔质量是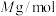 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
2024-01-20更新
|
326次组卷
|
3卷引用:2024届四川省绵阳市东辰中学高三下学期模拟考试(一)理科综合试题-高中化学
名校
解题方法
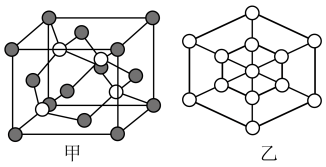
4 . 硼和镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。用于制氢的氨硼烷是非常有应用潜力的车载储氢材料之一,氨硼烷水解释放氢气,在催化剂存在条件下进行,该反应是氢元素间的归中反应,其反应方程式为:NH3BH3+2H2O= +
+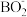 +3H2↑。回答下列问题:
+3H2↑。回答下列问题:
(1)基态B原子的最高能级电子排布式为___________ 。
(2)NH3BH3中所含元素电负性由大到小的顺序为___________ ,氨硼烷比其等电子体乙烷熔点高,原因是___________ 。
(3)反应方程式中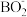 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出
中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出 的结构式:
的结构式:___________ 。
(4)一种含镓的药物合成方法如图所示:

①化合物Ⅰ中环上N原子的杂化方式为___________ ,1mol化合物Ⅰ中含有的C-H和C-Cσ键的数目共为___________ NA。
②化合物Ⅱ中Ga的配位数为___________ ,x=___________ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图甲所示,已知该晶体的密度为ρg/cm3),设NA是阿伏加德罗常数的值,若P原子半径为apm,晶胞中B、P原子相切,则B原子半径为___________ pm(写计算表达式);磷化硼晶胞沿着体对角线方向的投影(图乙中○表示P原子的投影),在图乙中用●画出B原子的投影位置___________ 。
 +
+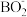 +3H2↑。回答下列问题:
+3H2↑。回答下列问题:(1)基态B原子的最高能级电子排布式为
(2)NH3BH3中所含元素电负性由大到小的顺序为
(3)反应方程式中
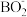 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出
中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出 的结构式:
的结构式:(4)一种含镓的药物合成方法如图所示:

①化合物Ⅰ中环上N原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图甲所示,已知该晶体的密度为ρg/cm3),设NA是阿伏加德罗常数的值,若P原子半径为apm,晶胞中B、P原子相切,则B原子半径为

您最近一年使用:0次
名校
5 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A.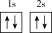 B.
B.
C. D.
D.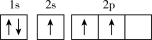
(2)基态N原子的成对电子数与未成对电子数之比为_______ , 离子的空间构型为
离子的空间构型为_______ 。
(3)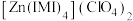 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和_______ 。
②已知NA为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B.
C.
 D.
D.
(2)基态N原子的成对电子数与未成对电子数之比为
 离子的空间构型为
离子的空间构型为(3)
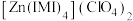 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于 的原因是
的原因是(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和②已知NA为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则该晶体的密度为
 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
您最近一年使用:0次
名校
解题方法
6 . H、N、O、S、Zn、Cu是日常生活中常见的元素。
(1)基态S原子的核外电子排布式为_____ ,其中两种自旋状态的电子数之比为_____ 。
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是_____ (填名称);第一电离能最大的元素是_____ (填名称)。1mol[Cu(NH3)4]2+中含有σ键的数目为_____ 。
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是_____ 。键角∠B-O-H不同于键角∠O-B-O的原因是_____ 。

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是__________ 。
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1, ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是_____ 。
②设阿伏加德罗常数的值为NA,则GaN晶体的密度为_____ g·cm-3。
(1)基态S原子的核外电子排布式为
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1,
 ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是②设阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
名校
7 . A、B、C、D、E、F均为周期表中前四周期的元素,且原子序数依次增大。请按要求回答下列问题。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因_______ 。
(2)量子力学把电子在原子核外的一个空间运动状态称为一个_______ ,电子除空间运动状态外,还有一种运动状态叫做_______ 。B是地壳中含量最高的元素,B基态原子的电子空间运动状态有_______ 种。
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关C、D的叙述正确的是_______ 。
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为_______ ,E的晶胞是六方最密堆积结构(如图1),E原子的配位数为_______ ;若E的相对原子质量为M,E原子半径为rcm。该晶胞的空间利用率为_______ (用含r、h的代数式表达,可以不必化简)。_______ (填“是”或否”),该立方体是不是F3B4的晶胞_______ (填“是”或“否”)。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因
| A2H4 | AH3 | |
| 熔点/°C | 2 | -77.8 |
| 沸点/°C | 113.5 | -33.5 |
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| C(或D) | 578 | 1817 | 2745 | 11578 |
| C(或D) | 738 | 1451 | 7733 | 10540 |
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为


您最近一年使用:0次
2023-06-10更新
|
426次组卷
|
3卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
名校
解题方法
8 . 生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
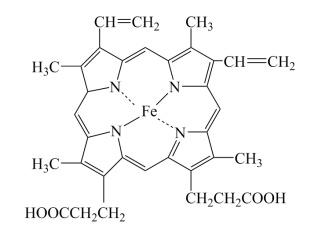
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(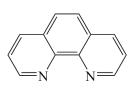 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
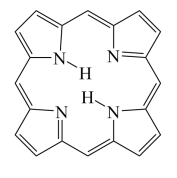
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
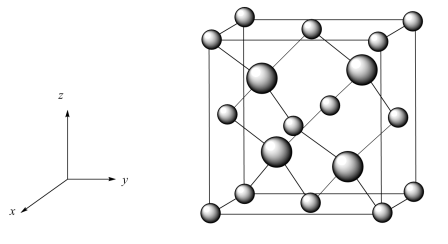
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
您最近一年使用:0次
2023-03-14更新
|
1064次组卷
|
2卷引用:四川省成都市第七中学2023届高三下学期二诊模拟考试理科综合化学试题
解题方法
9 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是_______ ,写出其基态原子的价电子排布式:_______ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
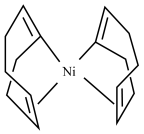
①与碳元素同周期且电负性大于碳的元素有_______ 种。
②Ni(cod)2分子内存在的作用力有_______ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为_______ 。
(3)葡萄糖(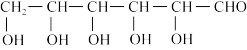 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 _______ 。
(4)下图三种叔醇的沸点从高到低的顺序及原因是_______ 。

(5)红银矿NiAs晶体结构如图所示:
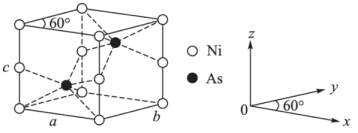
①Ni原子的配位数为_______ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和_______ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为_______ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。

①与碳元素同周期且电负性大于碳的元素有
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为
(3)葡萄糖(
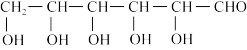 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)下图三种叔醇的沸点从高到低的顺序及原因是

(5)红银矿NiAs晶体结构如图所示:

①Ni原子的配位数为
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
名校
解题方法
10 . 2020年底,我国嫦娥五号月球探测器成功发射,进行无人采样后已顺利回收。
(1)月球表面的月海玄武岩中富含钛和铁,基态钛原子的核外电子排布式为_______ ,基态。
铁原子核外电子占据的最高能级的电子云轮廓图形状为_______ 。
(2)将月海玄武岩用硝酸溶解,所得溶液用KSCN检验,溶液呈红色。KSCN中K、C、N的电负性由大到小的顺序为_______ (用元素符号表示), SCN-中C原子的杂化方式为_______ , lmolSCN-中含有的σ键数目为_______ 。
(3)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。
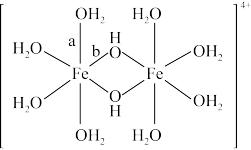
该双核阳离子中Fe原子的配位数为_______ ,配体H2O的VSEPR模型为_______ 。
(4)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是_______ 。
(5)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁的氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为_______ ;若该晶胞的晶胞参数为apm,a pm, 2a pm,则该晶胞的密度为_______ g·cm-3.(列出计算式即可)

(1)月球表面的月海玄武岩中富含钛和铁,基态钛原子的核外电子排布式为
铁原子核外电子占据的最高能级的电子云轮廓图形状为
(2)将月海玄武岩用硝酸溶解,所得溶液用KSCN检验,溶液呈红色。KSCN中K、C、N的电负性由大到小的顺序为
(3)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。

该双核阳离子中Fe原子的配位数为
(4)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是
(5)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁的氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为

您最近一年使用:0次



