2020年底,我国嫦娥五号月球探测器成功发射,进行无人采样后已顺利回收。
(1)月球表面的月海玄武岩中富含钛和铁,基态钛原子的核外电子排布式为_______ ,基态。
铁原子核外电子占据的最高能级的电子云轮廓图形状为_______ 。
(2)将月海玄武岩用硝酸溶解,所得溶液用KSCN检验,溶液呈红色。KSCN中K、C、N的电负性由大到小的顺序为_______ (用元素符号表示), SCN-中C原子的杂化方式为_______ , lmolSCN-中含有的σ键数目为_______ 。
(3)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。
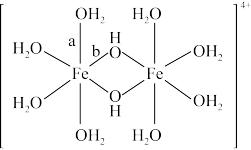
该双核阳离子中Fe原子的配位数为_______ ,配体H2O的VSEPR模型为_______ 。
(4)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是_______ 。
(5)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁的氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为_______ ;若该晶胞的晶胞参数为apm,a pm, 2a pm,则该晶胞的密度为_______ g·cm-3.(列出计算式即可)

(1)月球表面的月海玄武岩中富含钛和铁,基态钛原子的核外电子排布式为
铁原子核外电子占据的最高能级的电子云轮廓图形状为
(2)将月海玄武岩用硝酸溶解,所得溶液用KSCN检验,溶液呈红色。KSCN中K、C、N的电负性由大到小的顺序为
(3)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。

该双核阳离子中Fe原子的配位数为
(4)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是
(5)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁的氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为

更新时间:2022-07-06 23:45:48
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】嫦娥五号从月球采回的沙土中含有丰富的钛铁矿,还含有硅、铝、钾、锌、铜和稀土元素等。
(1)三价铁离子可以形成多种配位化合物。
① 电子排布式为
电子排布式为___________ 。
② 配体为
配体为___________ ;配体分子属于___________ 分子(填“极性”或“非极性”)。
③向 溶液中滴加
溶液中滴加 溶液,溶液变红色,继续滴加
溶液,溶液变红色,继续滴加 溶液,生成
溶液,生成 ,红色消失,由此可知离子稳定性:
,红色消失,由此可知离子稳定性:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)金属Ti的熔点比K高很多的原因为___________ 。
(3)锌与氮、镍形成的化合物,具备优越的催化活性,晶胞结构如图所示。
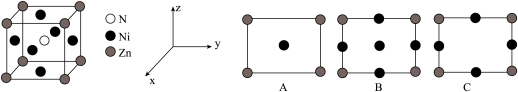
①与Zn原子距离最近且相等的Ni原子有___________ 个。
②该晶体沿z轴的投影图为___________ (填字母);晶胞参数为 ,该晶胞的密度为
,该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)三价铁离子可以形成多种配位化合物。
①
 电子排布式为
电子排布式为②
 配体为
配体为③向
 溶液中滴加
溶液中滴加 溶液,溶液变红色,继续滴加
溶液,溶液变红色,继续滴加 溶液,生成
溶液,生成 ,红色消失,由此可知离子稳定性:
,红色消失,由此可知离子稳定性:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)金属Ti的熔点比K高很多的原因为
(3)锌与氮、镍形成的化合物,具备优越的催化活性,晶胞结构如图所示。

①与Zn原子距离最近且相等的Ni原子有
②该晶体沿z轴的投影图为
 ,该晶胞的密度为
,该晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。D是地壳中含量最多的金属元素。E元素为同周期电负性最大的元素。D和E可形成化合物丙。F为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出F基态原子的外围电子排布式___________________________ 。
(2)B和C比较,第一电离能较大的元素是_____________ (填元素符号)。
(3)甲、乙两分子中含有非极性共价键的是_______________ (填分子式)。
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。
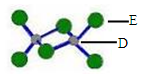
①丙属于_______________ 晶体。
②丙含有的作用力有____________ (填序号)。

A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为_________________ 。
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是________________ 。
(1)写出F基态原子的外围电子排布式
(2)B和C比较,第一电离能较大的元素是
(3)甲、乙两分子中含有非极性共价键的是
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。

①丙属于
②丙含有的作用力有

A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的价电子排布式:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
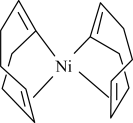
①与碳元素同周期且电负性大于碳的元素有___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为___________ 。
(3)葡萄糖( )分子中,手性碳原子个数为
)分子中,手性碳原子个数为___________ 。
(4)红银矿NiAs晶体结构如图所示:
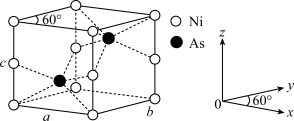
①As原子的配位数为___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为ρ g·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。

①与碳元素同周期且电负性大于碳的元素有
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为
(3)葡萄糖(
 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为(4)红银矿NiAs晶体结构如图所示:

①As原子的配位数为
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为ρ g·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】不同元素的原子在分子内吸引电子的能力大小可用一定数值 x 来表示,若 x 越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的 x 值:
(1)通过分析 x 值变化规律,确定Al、N的 x 值范围:________ < x (Al)<________
(2)推测 x 值与原子半径关系是________ ,根据短周期元素的 x 值变化特点,体现了元素性质的________ 变化规律。
(3)某有机化合物结构式为: ,其中SO键中你认为共用电子对偏向谁?
,其中SO键中你认为共用电子对偏向谁?________ (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是________ 。
(5)预测元素周期表中, x 值最小的元素的位置:_______ (放射性元素除外)。
下面是某些短周期元素的 x 值:
| 元素符号 | Li | Be | B | C | N | F |
| x 值 | 0.98 | 1.57 | 2.04 | 2.25 | 2.89 | 3.98 |
| 元素符号 | Na | Mg | Si | P | S | Cl |
| x 值 | 0.93 | 1.35 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测 x 值与原子半径关系是
(3)某有机化合物结构式为:
 ,其中SO键中你认为共用电子对偏向谁?
,其中SO键中你认为共用电子对偏向谁?(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是
(5)预测元素周期表中, x 值最小的元素的位置:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】锂电池的电解液是目前研究的热点。
(1)锂电池的电解液可采用溶有 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。
①基态 的电子云轮廓图的形状为
的电子云轮廓图的形状为_______ 。
②基态P原子的价层电子轨道表示式为_______ 。
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为 。
。_______ 。
②该阳离子中,带“*”的C原子的杂化轨道类型为_______ 杂化。
③根据VSEPR模型, 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为正八面体形。
(3) 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。_______ (填“ ”或“
”或“ ”)。
”)。
②距离 最近的
最近的 有
有_______ 个。
③已知 的摩尔质量是
的摩尔质量是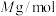 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
(1)锂电池的电解液可采用溶有
 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。①基态
 的电子云轮廓图的形状为
的电子云轮廓图的形状为②基态P原子的价层电子轨道表示式为
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为
 。
。
②该阳离子中,带“*”的C原子的杂化轨道类型为
③根据VSEPR模型,
 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。
 ”或“
”或“ ”)。
”)。②距离
 最近的
最近的 有
有③已知
 的摩尔质量是
的摩尔质量是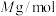 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___ 。
(2)在[Fe(CN)6]3-中不存在的化学键有__ 。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__ 。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__ ;分子中σ键和π键数目之比为__ 。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。
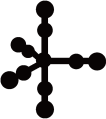
关于Fe(CO)5,下列说法正确的是__ 。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
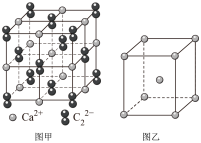
(5)与C22-互为等电子体的微粒__ (写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__ 。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__ nm(用含有d、NA的代数式表示)。
(1)基态Fe2+核外电子排布式为
(2)在[Fe(CN)6]3-中不存在的化学键有
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
(5)与C22-互为等电子体的微粒
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
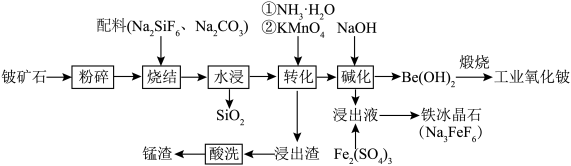
【推荐2】铍作为一种稀有元素,在航空航天、电子加工等领域具有重要意义。用铍矿石(含BeO及少量Ca、Mg、Mn元素)与配料生产工业氧化铍的工艺流程如下: 的还原产物为
的还原产物为 。回答下列问题:
。回答下列问题:
(1)若缺少粉碎步骤,产生的影响为_______ 。
(2)烧结时,若铍矿石中BeO恰好转化为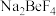 ,Si元素转化为
,Si元素转化为 ,则BeO发生反应的化学方程式为
,则BeO发生反应的化学方程式为_______ 。
(3)水浸后溶液中仍有未反应的 ,加入
,加入 后会转化为
后会转化为 沉淀,所得产物可除去溶液中的钙、镁元素,
沉淀,所得产物可除去溶液中的钙、镁元素, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)水浸后溶液中Mn元素以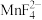 形式存在,加入稍过量
形式存在,加入稍过量 溶液煮沸50min至溶液
溶液煮沸50min至溶液______ 时说明反应结束。结合平衡移动原理解释酸洗时控制溶液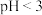 的原因:
的原因:______ 。
(5)碱化时,室温下加入NaOH,控制 ,析出颗粒状的
,析出颗粒状的 ,所得浸出液中
,所得浸出液中 ,此时溶液中
,此时溶液中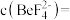
___  。已知
。已知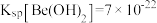 ,
,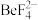 的解离常数
的解离常数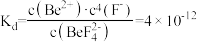
(6)碱化后浸出液中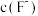 远高于排放标准,向其中加入硫酸铁生成
远高于排放标准,向其中加入硫酸铁生成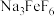 ,
, 为八面体结构,则Fe原子采取的杂化方式为
为八面体结构,则Fe原子采取的杂化方式为____ (填标号)。
A. B.
B. C.
C.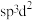
 的还原产物为
的还原产物为 。回答下列问题:
。回答下列问题:(1)若缺少粉碎步骤,产生的影响为
(2)烧结时,若铍矿石中BeO恰好转化为
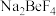 ,Si元素转化为
,Si元素转化为 ,则BeO发生反应的化学方程式为
,则BeO发生反应的化学方程式为(3)水浸后溶液中仍有未反应的
 ,加入
,加入 后会转化为
后会转化为 沉淀,所得产物可除去溶液中的钙、镁元素,
沉淀,所得产物可除去溶液中的钙、镁元素, 发生反应的离子方程式为
发生反应的离子方程式为(4)水浸后溶液中Mn元素以
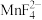 形式存在,加入稍过量
形式存在,加入稍过量 溶液煮沸50min至溶液
溶液煮沸50min至溶液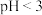 的原因:
的原因:(5)碱化时,室温下加入NaOH,控制
 ,析出颗粒状的
,析出颗粒状的 ,所得浸出液中
,所得浸出液中 ,此时溶液中
,此时溶液中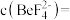
 。已知
。已知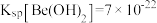 ,
,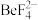 的解离常数
的解离常数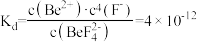
(6)碱化后浸出液中
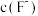 远高于排放标准,向其中加入硫酸铁生成
远高于排放标准,向其中加入硫酸铁生成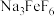 ,
, 为八面体结构,则Fe原子采取的杂化方式为
为八面体结构,则Fe原子采取的杂化方式为A.
 B.
B. C.
C.
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】我国在新材料领域的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站的制作材料中含有B、C、N、P、Ti、Ni、Cu等元素。回答下列问题:
(1)下列硼元素的不同微粒,失去一个电子需要吸收能量最大的是___________ (填标号,下同);用光谱仪可捕捉到发射光谱的是___________ 。___________ 。制备氮化硼(BN)的一种方法为 ,则
,则 和
和 的键角较大的是
的键角较大的是___________ (填化学式)。
(3)一种 配合物的结构如图所示。
配合物的结构如图所示。___________ (填元素符号)。
②该配合物中 的配位数为
的配位数为___________ 。
③该配合物中存在的化学键类型有___________ (填标号)。
A.离子键 B. 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键
(4)铁基合金中掺入B、N、P等元素可提高韧性、强度、耐磨性等。
① 的沸点高于
的沸点高于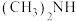 的主要原因为
的主要原因为___________ 。
②液态磷酸的导电机理如下图所示。液态磷酸中存在的两种离子符号为___________ ,其中阳离子中 原子的杂化方式为
原子的杂化方式为___________ 。 掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。 ,相对分子质量为M,NA表示阿伏加德罗常数的数值,则晶胞中距离最近的两个Ga原子间距离为
,相对分子质量为M,NA表示阿伏加德罗常数的数值,则晶胞中距离最近的两个Ga原子间距离为___________  。
。
②掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为___________ (化为最简整数比)。
(1)下列硼元素的不同微粒,失去一个电子需要吸收能量最大的是
A.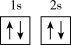 B.
B.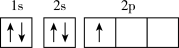
C. 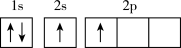 D.
D.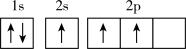
 ,则
,则 和
和 的键角较大的是
的键角较大的是(3)一种
 配合物的结构如图所示。
配合物的结构如图所示。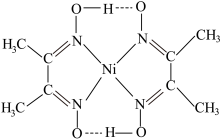
②该配合物中
 的配位数为
的配位数为③该配合物中存在的化学键类型有
A.离子键 B.
 键 C.
键 C. 键 D.氢键 E.配位键
键 D.氢键 E.配位键(4)铁基合金中掺入B、N、P等元素可提高韧性、强度、耐磨性等。
①
 的沸点高于
的沸点高于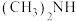 的主要原因为
的主要原因为②液态磷酸的导电机理如下图所示。液态磷酸中存在的两种离子符号为
 原子的杂化方式为
原子的杂化方式为
 掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
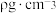 ,相对分子质量为M,NA表示阿伏加德罗常数的数值,则晶胞中距离最近的两个Ga原子间距离为
,相对分子质量为M,NA表示阿伏加德罗常数的数值,则晶胞中距离最近的两个Ga原子间距离为 。
。②掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】A、B、C、D、E、F、G为前四周期元素。A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素,基态G原子核外电子填充在7个能级中,且价层电子均为单电子。
(1)元素B、C、D的第一电离能由大到小的顺序为______________ (用元素符号表示)。
(2)ED3分子的空间构型为________ ,中心原子的杂化方式为_________ 。
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是__________ (填序号)。
(4)CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是_________ (填序号)。
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5) EBC-的等电子体中属于分子的有__________ (填化学式),EBC-的电子式为______________ 。
(6)G的价层电子排布式为________ ,化合物[G(CA3)6]F3的中心离子的配位数为_____________ 。
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:
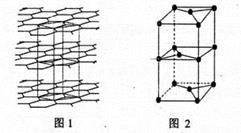
①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为_____________ 。
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为______________ g.cm-3。
(1)元素B、C、D的第一电离能由大到小的顺序为
(2)ED3分子的空间构型为
(3)四种分子①BA4②ED3③A2D④CA3键角由大到小排列的顺序是
(4)CA3分子可以与A+离子结合成CA4+离子,这个过程中发生改变的是
a.微粒的空间构型 b.C原子的杂化类型
c.A-C-A的键角 d.微粒的电子数
(5) EBC-的等电子体中属于分子的有
(6)G的价层电子排布式为
(7)B的某种单质的片层与层状结构如图1所示,其中层间距离为hcm.图2为从层状结构中取出的晶胞。试回答:

①在B的该种单质的片层结构中,B原子数、B-B键数、六元环数之比为
②若B的该种单质中B-B键长为a cm,则B的该种单质的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】据古籍《燕闲清赏笺》记载:“宣窑之青,乃苏勃泥青”,说明宣德时期青花瓷使用的颜料是“苏勃泥青”,它是从一种钻毒砂[主要成分:( ,
, )
) ]中提取出来的。回答下列问题:
]中提取出来的。回答下列问题:
(1)基态S原子的价层电子排布图为_______ ,其原子核外电子共有_______ 种空间运动状态。
(2)比较元素第一电离能:S_______ P(填“>”、“<”或=)。
(3) 位于周期表的第
位于周期表的第_______ 周期 _______ 族,_______ (填“d”或“ds”)区。
(4)区分晶体与非晶体最可靠的科学方法是_______ 。
(5)砷化镓晶胞结构如图所示。晶胞中 与周围最近且等距的
与周围最近且等距的 形成的空间结构为
形成的空间结构为_______ 。已知 晶胞棱长为apm,其密度
晶胞棱长为apm,其密度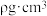 ,则阿伏加德罗常数的数值为
,则阿伏加德罗常数的数值为_______ (列出计算式即可, 的摩尔质量为
的摩尔质量为 )。
)。

(6) 的熔点为
的熔点为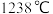 ,
, 与
与 晶体类型相同,
晶体类型相同, 的熔点
的熔点_______ (填“>”、“<”或“=”)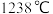 。
。
 ,
, )
) ]中提取出来的。回答下列问题:
]中提取出来的。回答下列问题:(1)基态S原子的价层电子排布图为
(2)比较元素第一电离能:S
(3)
 位于周期表的第
位于周期表的第(4)区分晶体与非晶体最可靠的科学方法是
(5)砷化镓晶胞结构如图所示。晶胞中
 与周围最近且等距的
与周围最近且等距的 形成的空间结构为
形成的空间结构为 晶胞棱长为apm,其密度
晶胞棱长为apm,其密度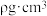 ,则阿伏加德罗常数的数值为
,则阿伏加德罗常数的数值为 的摩尔质量为
的摩尔质量为 )。
)。
(6)
 的熔点为
的熔点为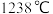 ,
, 与
与 晶体类型相同,
晶体类型相同, 的熔点
的熔点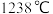 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】高锰酸钾、重铬酸钾和高铁酸钾是中学常见的强氧化剂。请回答下列问题:
(1)基态Cr原子价层电子的运动状态有_______ 种,某同学在描述基态Cr原子的电子排布式时,将其表示为[ Ar]3d44s2,该表示违背了_______ 。
(2)+3价铁的强酸盐溶于水,可逐渐水解产生黄色的[Fe(OH)(H2O)5]+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。
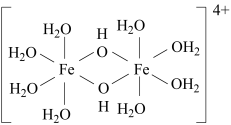
①含s、p、d轨道的杂化类型有dsp2、sp3d、sp3d2,则[Fe(OH)(H2O)5]2+中Fe的杂化类型为_______ ,1 mol [Fe(OH)(H2O)5]2+中含有的σ键的数目为_______ (用NA表示阿伏加德罗常数的值)。
②二聚体[Fe2(OH)2(H2O)8]4+中,Fe的配位数为_______ 。
(3)K与Cu位于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低的原因是_______ 。
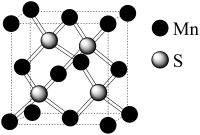
(4)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞结构如图所示。在MnS中,每个Mn原子周围距离相等且最近的Mn原子数为_______ 个;若MnS晶胞的边长为a pm,则MnS的密度表达式为_______ g·cm-3
(1)基态Cr原子价层电子的运动状态有
(2)+3价铁的强酸盐溶于水,可逐渐水解产生黄色的[Fe(OH)(H2O)5]+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。

①含s、p、d轨道的杂化类型有dsp2、sp3d、sp3d2,则[Fe(OH)(H2O)5]2+中Fe的杂化类型为
②二聚体[Fe2(OH)2(H2O)8]4+中,Fe的配位数为
(3)K与Cu位于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低的原因是
(4)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞结构如图所示。在MnS中,每个Mn原子周围距离相等且最近的Mn原子数为

您最近一年使用:0次



