名校
解题方法
1 . 2020年底,我国嫦娥五号月球探测器成功发射,进行无人采样后已顺利回收。
(1)月球表面的月海玄武岩中富含钛和铁,基态钛原子的核外电子排布式为_______ ,基态。
铁原子核外电子占据的最高能级的电子云轮廓图形状为_______ 。
(2)将月海玄武岩用硝酸溶解,所得溶液用KSCN检验,溶液呈红色。KSCN中K、C、N的电负性由大到小的顺序为_______ (用元素符号表示), SCN-中C原子的杂化方式为_______ , lmolSCN-中含有的σ键数目为_______ 。
(3)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。
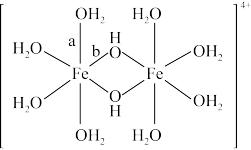
该双核阳离子中Fe原子的配位数为_______ ,配体H2O的VSEPR模型为_______ 。
(4)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是_______ 。
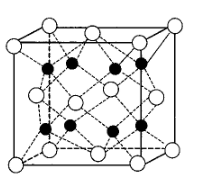
(5)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁的氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为_______ ;若该晶胞的晶胞参数为apm,a pm, 2a pm,则该晶胞的密度为_______ g·cm-3.(列出计算式即可)

(1)月球表面的月海玄武岩中富含钛和铁,基态钛原子的核外电子排布式为
铁原子核外电子占据的最高能级的电子云轮廓图形状为
(2)将月海玄武岩用硝酸溶解,所得溶液用KSCN检验,溶液呈红色。KSCN中K、C、N的电负性由大到小的顺序为
(3)水溶液中Fe3+发生水解,水解过程中出现双核阳离子[Fe2(H2O)8(OH)2]4+。

该双核阳离子中Fe原子的配位数为
(4)已知FeF3的熔点(1000℃)显著高于FeCl3的熔点(306℃),原因是
(5)铁的氧化物有多种,科研工作者常使用FexOy来表示各种铁的氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为

您最近一年使用:0次
解题方法
2 . 材料是人类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题:
(1)按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为_______ ( 选填标号)。
(2)已知:第四周期中3d轨道上没有未成对电子的过渡元素离子的水合离子为无色。下列离子形成的水合离子为无色的是_______。
(3)K3[Fe(CN)6]中所含元素电负性由大到小的顺序为_______ ,lmol K3[Fe(CN)6]含有_______ molσ键;Ti3+能形成化合物[TiCl(H2O)5]Cl2·H2O,该化合物中Ti3+的配位数为_______ 。
(4)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:_______ 。
(5)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在 、
、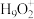 等微粒。
等微粒。
①H2O分子的键角小于H3O+离子的键角,原因是_______ 。
②画出 可能的一种结构式
可能的一种结构式_______ 。
(6)TiO2通过氮掺杂反应生成TiO2-xNy,表示如图。
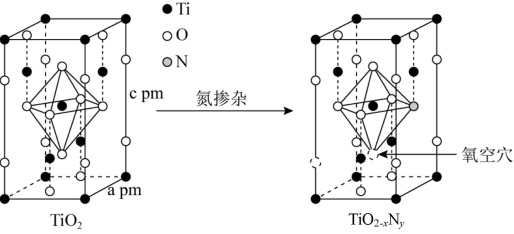
①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为_______ g/cm3。
②图乙的结构可用化学式TiO2-xNy表示,其中x=_______ 。
(1)按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为_______ ( 选填标号)。
A.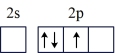 | B.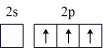 |
C.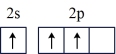 | D.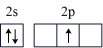 |
| A.Sc3+ | B.Cr3+ | C.Fe3+ | D.Zn2+ |
(4)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:
(5)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在
 、
、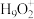 等微粒。
等微粒。①H2O分子的键角小于H3O+离子的键角,原因是
②画出
 可能的一种结构式
可能的一种结构式(6)TiO2通过氮掺杂反应生成TiO2-xNy,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为
②图乙的结构可用化学式TiO2-xNy表示,其中x=
您最近一年使用:0次
3 . 磷酸氯喹是用于治疗疟疾的药物,有研究表明该药物在细胞水平上能有效抑制新型冠状病毒2019-nCoV的感染。磷酸氯喹的结构简式如下图,请回答下列问题。

(1)基态P原子中,电子占据的最高能级符号为___________ , 基态Cl原子价层电子排布式为___________ 。
(2)磷酸氯喹分子中电负性最大的元素是___________ ; 第一电离能I(P)___________ I(C1)(填“>”或“<”)。
(3)磷酸氯喹中C原子的杂化方式为___________ ,NH3沸点比AsH3的沸点高,其理由是_____ 。
(4)磷酸根离子的空间构型为___________ , 磷酸分子中π键数为___________ 。
(5)金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示,晶胞中P的配位数为___________ , 已知晶胞参数为a nm,则晶体的密度为___________ g·cm-3(列出计算表式,阿伏加德罗常数用NA表示)。

(1)基态P原子中,电子占据的最高能级符号为
(2)磷酸氯喹分子中电负性最大的元素是
(3)磷酸氯喹中C原子的杂化方式为
(4)磷酸根离子的空间构型为
(5)金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示,晶胞中P的配位数为

您最近一年使用:0次
名校
解题方法
4 . 碳元素能形成多种单质及化合物,在生产生活中有重要的研究和应用价值。请根据以下信息,回答下列问题。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。
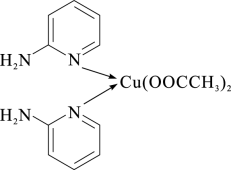
①在元素周期表中铜位于_______ 区(填“s”、“p”、“d”或“ds”)。C、N、O三种元素的电负性由大到小的顺序为_______ 。
②邻氨基吡啶的铜配合物中,Cu2+的配位数是_______ ,N原子的杂化类型有_______ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
①1体积水可溶解约1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_______ ,反应时,向饱和NaCl溶液中先通入_______ 。
②NaHCO3分解得Na2CO3, 空间结构为
空间结构为_______ 。
(3)碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。
①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是_______ 。
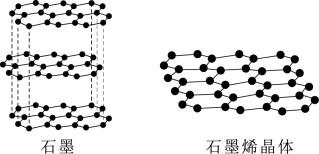
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。
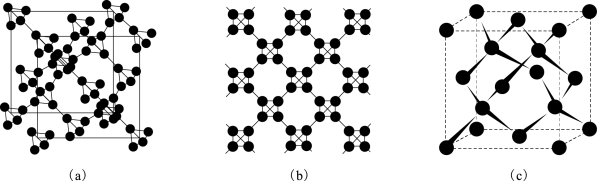
一个T-碳晶胞中含有_______ 个碳原子,T-碳的密度非常小为金刚石的一半,则T-碳晶胞的边长和金刚石晶胞的边长之比为_______ 。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。

①在元素周期表中铜位于
②邻氨基吡啶的铜配合物中,Cu2+的配位数是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
①1体积水可溶解约1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3,
 空间结构为
空间结构为(3)碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。
①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。

一个T-碳晶胞中含有
您最近一年使用:0次
2022-06-26更新
|
377次组卷
|
2卷引用:2024届四川省泸县第五中学高三上学期一诊模拟考试理综试题
名校
5 . 锌及其化合物在科学技术发展和人类生产生活中发挥着重要作用。
(1)明朝《天工开物》中就已经记载了我国古代的炼锌技术:以炉甘石(ZnCO3)和木炭为原料高温制取锌。请写出Zn2+的价电子排布轨道式_______ ,ZnCO3中C原子的杂化形式为_______ ,Zn、C、O的电负性由小到大的顺序是_______ 。
(2)“此物(“锌火”)无铜收伏,入火即成烟飞去”,意思是锌的沸点(907℃)较低,宜与铜熔合制成黄铜。已知Zn与Cu的能量变化如下所示:
Cu(g)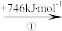 Cu+(g)
Cu+(g) Cu2+(g)
Cu2+(g)
Zn(g)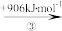 Zn+(g)
Zn+(g)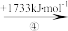 Zn2+(g)
Zn2+(g)
①试解释步骤②吸收能量大于步骤④的原因_______ 。
②金属锌采取如图1所示堆积方式:
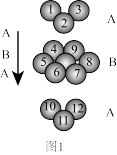
该堆积方式类型与金属铜的堆积方式_______ (填“相同”或“不相同”)。
(3)我国科学家最新研制成功了一种纳米半导体材料可以高效实现光化学转换,该种材料主要成分为硫化镉和硫化锌。Cd与Zn位于同一副族,且在Zn的下一周期。已知ZnS熔点为2830℃;CdS熔点为1750℃,ZnS熔点更高的原因为_______ 。
(4)独立的NH3分子中,H—N—H键键角为107°18',请解释[Zn(NH3)6]2+离子中H—N—H键角变为109.5°的原因是_______ 。根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是_______ 。
A. 和
和 B.
B. 和SO3 C.H3O+和
和SO3 C.H3O+和 D.
D. 和
和
(5)图2为ZnS晶胞,图3为晶胞沿z轴的1∶1投影平面图:
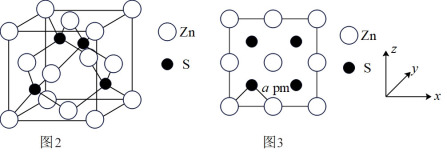
①晶胞中最近的两个S原子之间的距离为_______ pm(含字母a写计算表达式)。
②已知S2-半径为bpm,若晶胞中S2-、Zn2+相切,则Zn2+半径为_______ pm(写计算表达式)。(含字母a、b写计算表达式)。
(1)明朝《天工开物》中就已经记载了我国古代的炼锌技术:以炉甘石(ZnCO3)和木炭为原料高温制取锌。请写出Zn2+的价电子排布轨道式
(2)“此物(“锌火”)无铜收伏,入火即成烟飞去”,意思是锌的沸点(907℃)较低,宜与铜熔合制成黄铜。已知Zn与Cu的能量变化如下所示:
Cu(g)
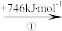 Cu+(g)
Cu+(g) Cu2+(g)
Cu2+(g)Zn(g)
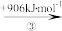 Zn+(g)
Zn+(g)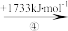 Zn2+(g)
Zn2+(g)①试解释步骤②吸收能量大于步骤④的原因
②金属锌采取如图1所示堆积方式:

该堆积方式类型与金属铜的堆积方式
(3)我国科学家最新研制成功了一种纳米半导体材料可以高效实现光化学转换,该种材料主要成分为硫化镉和硫化锌。Cd与Zn位于同一副族,且在Zn的下一周期。已知ZnS熔点为2830℃;CdS熔点为1750℃,ZnS熔点更高的原因为
(4)独立的NH3分子中,H—N—H键键角为107°18',请解释[Zn(NH3)6]2+离子中H—N—H键角变为109.5°的原因是
A.
 和
和 B.
B. 和SO3 C.H3O+和
和SO3 C.H3O+和 D.
D. 和
和
(5)图2为ZnS晶胞,图3为晶胞沿z轴的1∶1投影平面图:

①晶胞中最近的两个S原子之间的距离为
②已知S2-半径为bpm,若晶胞中S2-、Zn2+相切,则Zn2+半径为
您最近一年使用:0次
6 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: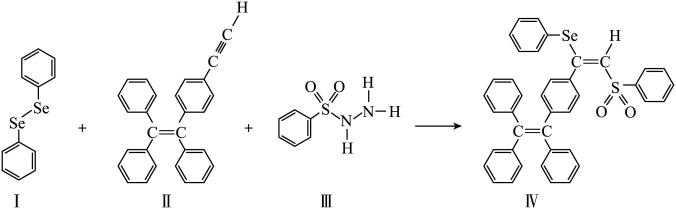
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
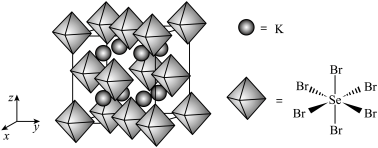
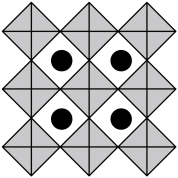
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-06-10更新
|
12643次组卷
|
28卷引用:四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题
四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)T35-物质结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题上海市实验学校2023-2024学年高三上学期第一次月考化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题广东省广州中学2022-2023学年高二下学期期中考试化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题广东省广州市第六十五中学2023-2024学年高二下学期期中考试化学试题
名校
7 . 富镍三层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为新一代锂电池的正极材料,被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题。
(1)基态氧原子中能量最高的电子,其电子云有___________ 个伸展方向 (取向) ;基态Mn原子的电子排布式为___________ 。
(2)Ni2+在水中以水合离子[Ni(H2O)6]2+形式存在,它与乙二胺 ( ,简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。
,简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。
①1个乙二胺分子中含sp3杂化的原子个数为___________ ,分子中电负性最大的元素是___________ ;
②Ni(H2O)6]2+中H2O与Ni2+之间以___________ 键结合在一起,在与乙二胺反应的过程中,Ni2+的轨道杂化类型是否发生改变?___________ (填“是”或“否”) ;
③沸点:乙二胺(116°C)<乙二醇(197°C), 其原因是:___________ 。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子分数坐标。已知TiO2为四方晶系(长方体形),晶胞参数为459pm、459pm、 295pm。 如图为沿y轴投影的晶胞中所有O原子和Ti原子的分布图和原子分数坐标。
①该晶胞中O原子的数目为___________ 。
②设NA为阿伏加德罗常数的值,TiO2 的摩尔质量为80g/mol,则TiO2晶胞的密度为___________ g·cm-3(列出计算表达式)
(1)基态氧原子中能量最高的电子,其电子云有
(2)Ni2+在水中以水合离子[Ni(H2O)6]2+形式存在,它与乙二胺 (
 ,简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。
,简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。①1个乙二胺分子中含sp3杂化的原子个数为
②Ni(H2O)6]2+中H2O与Ni2+之间以
③沸点:乙二胺(116°C)<乙二醇(197°C), 其原因是:
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子分数坐标。已知TiO2为四方晶系(长方体形),晶胞参数为459pm、459pm、 295pm。 如图为沿y轴投影的晶胞中所有O原子和Ti原子的分布图和原子分数坐标。
①该晶胞中O原子的数目为
②设NA为阿伏加德罗常数的值,TiO2 的摩尔质量为80g/mol,则TiO2晶胞的密度为

您最近一年使用:0次
2022-06-10更新
|
431次组卷
|
4卷引用:四川省泸州市2022届高三下学期第三次教学质量诊断性考试理科综合化学试题
四川省泸州市2022届高三下学期第三次教学质量诊断性考试理科综合化学试题2024届四川省泸县第四中学高三上学期一诊模拟考试理综试题2024届四川省泸州市高三下学期第三次教学质量诊新性考试理综试题-高中化学(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
解题方法
8 . 我国科学家研究发现AgGrS2在室温下具有超离子行为(原子可在晶体中自由移动)。回答下列问题:
(1)基态铬原子的核外电子排布式为___________ , 基态硫原子核外有___________ 种不同运动状态的电子。
(2)与硫元素同族的几种元素中,电负性最大的是___________ ( 填元素符号)。常见含硫的微粒有SO2、SO3、 、
、 、 H2S等,
、 H2S等, 的空间构型为
的空间构型为___________ ; 请写出与H2S互为等电子体的一种微粒的化学式___________ ;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2,原因是___________ 。
(3)Ag+与氨水形成的二氨合银配离子[Ag(NH3)2]+的空间构型是直线型,则其中心原子的杂化类型是_____ ,该配离子中的配位原子是___________ (填元素符号),lmol该配离子中含有的σ键的数目为________ 。
(4)复合材料氧铬酸钙的立方晶胞如图所示。
已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为___________ ,该物质的化学式为___________ ,已 知钙和氧的最近距离为a pm。晶体的密度ρ g·cm-3,则阿伏加德罗常数NA=___________ mol-1( 用含a和ρ的式子表示,列出计算式即可)。
(1)基态铬原子的核外电子排布式为
(2)与硫元素同族的几种元素中,电负性最大的是
 、
、 、 H2S等,
、 H2S等, 的空间构型为
的空间构型为(3)Ag+与氨水形成的二氨合银配离子[Ag(NH3)2]+的空间构型是直线型,则其中心原子的杂化类型是
(4)复合材料氧铬酸钙的立方晶胞如图所示。

已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为
您最近一年使用:0次
2022-05-30更新
|
1287次组卷
|
2卷引用:四川省绵阳市2023届高三零诊模拟检测试题理科综合化学试题
解题方法
9 . 某笼形包合物Ni(CN)a(NH3)b(C6H6)c的晶胞如图所示。回答下列有关问题。
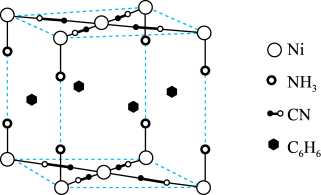
(1)基态镍原子的价层电子排布式为_______ ;该物质中非金属元素电负性由大到小是_______ 。
(2)NH3中N的杂化轨道类型为_______ ;从结构角度分析C、P原子之间不易形成π键的原因是_______ 。
(3)在晶胞中,镍离子与CN-之间产生配位键,配体CN-提供的配位原子有_______ ;镍离子的配位数为_______ 。
(4)推测该包合物中氨与苯分子数目比,即b:c为_______ ,其中Ni的平均化合价为_______ 。
(5)若此晶胞体积为Vnm3,阿伏加德罗常数为NAmol-1,晶胞的摩尔质量为Mg/mol,则晶体密度为_______ g/cm3(列出计算表达式)。

(1)基态镍原子的价层电子排布式为
(2)NH3中N的杂化轨道类型为
(3)在晶胞中,镍离子与CN-之间产生配位键,配体CN-提供的配位原子有
(4)推测该包合物中氨与苯分子数目比,即b:c为
(5)若此晶胞体积为Vnm3,阿伏加德罗常数为NAmol-1,晶胞的摩尔质量为Mg/mol,则晶体密度为
您最近一年使用:0次
解题方法
10 . 镓(31Ga)是化学史上第一种先理论预言,后在自然界中被发现并验证的元素。镓的化合物半导体广泛用于电子与微电子工业。
(1)基态Ga原子中,核外电子占据的最高能层的符号是_______ 。
(2)门捷列夫预言的“类硼”(即钪,21Sc),“类铝”(即镓,31Ga),“类硅”(即锗,32Ge)三种元素中,未成对电子数最多的是_______ (填元素符号)。
(3)氮化镓(GaN)和砷化镓(GaAs)都是新型的半导体材料,与晶体硅属于同一晶体类型。
①Ga、N、As三种元素的电负性由大到小的顺序是_______ 。
②GaN熔点(1700℃)高于GaAs熔点(1238℃)的原因是_______ 。
③GaAs可由Ga(CH3)3和AsH3在一定条件下制得,该反应的化学方程式是_______ ,Ga(CH3)3分子中Ga原子的杂化方式是_______ ,AsH3分子的空间构型是_______ 。
(4)钆镓石榴石是一种激光介质材料,其晶体结构单位简图如下。
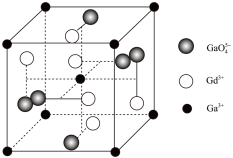
①钆镓石榴石的化学式是_______ 。
②已知晶体结构单位的边长为a nm,晶体的密度为ρ g·cm−3,则阿伏加德罗常数NA=_______ (用含a、ρ的代数式表示)。
(1)基态Ga原子中,核外电子占据的最高能层的符号是
(2)门捷列夫预言的“类硼”(即钪,21Sc),“类铝”(即镓,31Ga),“类硅”(即锗,32Ge)三种元素中,未成对电子数最多的是
(3)氮化镓(GaN)和砷化镓(GaAs)都是新型的半导体材料,与晶体硅属于同一晶体类型。
①Ga、N、As三种元素的电负性由大到小的顺序是
②GaN熔点(1700℃)高于GaAs熔点(1238℃)的原因是
③GaAs可由Ga(CH3)3和AsH3在一定条件下制得,该反应的化学方程式是
(4)钆镓石榴石是一种激光介质材料,其晶体结构单位简图如下。

①钆镓石榴石的化学式是
②已知晶体结构单位的边长为a nm,晶体的密度为ρ g·cm−3,则阿伏加德罗常数NA=
您最近一年使用:0次



