名校
1 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A.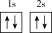 B.
B.
C. D.
D.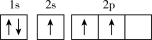
(2)基态N原子的成对电子数与未成对电子数之比为_______ , 离子的空间构型为
离子的空间构型为_______ 。
(3)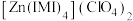 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)镍能形成多种配合物,其中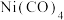 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于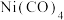 的原因是
的原因是_______ 。
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和_______ 。
②已知NA为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B.
C.
 D.
D.
(2)基态N原子的成对电子数与未成对电子数之比为
 离子的空间构型为
离子的空间构型为(3)
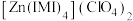 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)镍能形成多种配合物,其中
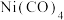 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于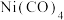 的原因是
的原因是(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和②已知NA为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则该晶体的密度为
 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . A、B、C、D、E、F均是短周期元素,其原子序数依次增大,A和B同周期,A和E同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C、D的阳离子电子层结构相同,C与B可生成C2B或C2B2,D的阳离子半径是同周期最小的,F的原子半径是所在周期中最小的。请回答:
(1)E在元素周期表中的位置是_______ 。
(2)C所在周期电负性最强的是_______ ;AB2的结构式是_______ 。
(3)B、C、F的离子半径由大到小的顺序为_______ (用化学式回答,下同);A、D、E元素的最高价氧化物对应水化物中,酸性最强的是_______ 。
(4)B的简单氢化物比H2S沸点高的原因是_______ 。
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:_______ 。
(6)用一个离子方程式证明A、E的非金属性强弱:_______ 。
(1)E在元素周期表中的位置是
(2)C所在周期电负性最强的是
(3)B、C、F的离子半径由大到小的顺序为
(4)B的简单氢化物比H2S沸点高的原因是
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:
(6)用一个离子方程式证明A、E的非金属性强弱:
您最近一年使用:0次
解题方法
3 . 工业上制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3,请回答下列问题:
(1)上述反应体系中出现的几种短周期元素中,第二周期元素电负性由大到小的顺序是_____ 。
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于气态有机物的电子式是_____ ,该分子为_____ (填“极性”或“非极性”)分子;
(3)PH3分子与NH3分子结构相似PH3相对分子质量大于NH3,但NH3沸点高于PH3,其原因是:_____ ;
(4)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式[Mn(CO)5(CH3CN)],
①Mn原子的配位数为_____ ;
②CH3CN中C原子的杂化类型为:_____ ;
③CH3CN中σ键与π键数目之比为:_____ ;
(5)化合物FeF3熔点高于1000°C而Fe(CO)5的熔点却低于0°C,FeF3熔点远高于Fe(CO)5的原因可能是_____ ;
(6)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O;
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为_____ ;
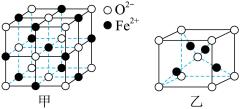
②Cu2O立方晶胞结构如图乙所示,若晶胞参数为apm,则该晶体的密度为_____ g/cm3(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)。
(1)上述反应体系中出现的几种短周期元素中,第二周期元素电负性由大到小的顺序是
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于气态有机物的电子式是
(3)PH3分子与NH3分子结构相似PH3相对分子质量大于NH3,但NH3沸点高于PH3,其原因是:
(4)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式[Mn(CO)5(CH3CN)],
①Mn原子的配位数为
②CH3CN中C原子的杂化类型为:
③CH3CN中σ键与π键数目之比为:
(5)化合物FeF3熔点高于1000°C而Fe(CO)5的熔点却低于0°C,FeF3熔点远高于Fe(CO)5的原因可能是
(6)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O;
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为

②Cu2O立方晶胞结构如图乙所示,若晶胞参数为apm,则该晶体的密度为
您最近一年使用:0次
2023-06-21更新
|
143次组卷
|
2卷引用:四川省成都市新都区2022-2023学年高三上学期期末摸底测试理科综合化学试题
名校
解题方法
4 . H、N、O、S、Zn、Cu是日常生活中常见的元素。
(1)基态S原子的核外电子排布式为_____ ,其中两种自旋状态的电子数之比为_____ 。
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是_____ (填名称);第一电离能最大的元素是_____ (填名称)。1mol[Cu(NH3)4]2+中含有σ键的数目为_____ 。
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是_____ 。键角∠B-O-H不同于键角∠O-B-O的原因是_____ 。

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是__________ 。
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1, ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是_____ 。
②设阿伏加德罗常数的值为NA,则GaN晶体的密度为_____ g·cm-3。
(1)基态S原子的核外电子排布式为
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是

(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。

①若图3中原子5的分数坐标是(1,
 ,
, ),则原子1的分数坐标是
),则原子1的分数坐标是②设阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
名校
5 . A、B、C、D、E、F均为周期表中前四周期的元素,且原子序数依次增大。请按要求回答下列问题。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因_______ 。
(2)量子力学把电子在原子核外的一个空间运动状态称为一个_______ ,电子除空间运动状态外,还有一种运动状态叫做_______ 。B是地壳中含量最高的元素,B基态原子的电子空间运动状态有_______ 种。
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关C、D的叙述正确的是_______ 。
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
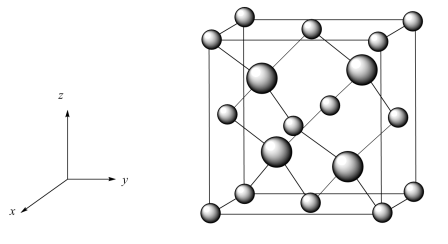
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为_______ ,E的晶胞是六方最密堆积结构(如图1),E原子的配位数为_______ ;若E的相对原子质量为M,E原子半径为rcm。该晶胞的空间利用率为_______ (用含r、h的代数式表达,可以不必化简)。_______ (填“是”或否”),该立方体是不是F3B4的晶胞_______ (填“是”或“否”)。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因
| A2H4 | AH3 | |
| 熔点/°C | 2 | -77.8 |
| 沸点/°C | 113.5 | -33.5 |
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| C(或D) | 578 | 1817 | 2745 | 11578 |
| C(或D) | 738 | 1451 | 7733 | 10540 |
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为


您最近一年使用:0次
2023-06-10更新
|
426次组卷
|
3卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
名校
解题方法
6 . CuO、Cu2S等含铜化合物可以催化合成HCOOH。回答下列问题:
(1)基态铜原子的价电子排布式为___________ ,其核外电子占据的原子轨道共有___________ 个。
(2)HCOOH中元素电负性从大到小的顺序为___________ ;催化过程中可能产生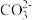 ,
,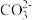 的空间构型为
的空间构型为___________ ,碳氧键的平均键长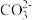 比CH3OH要
比CH3OH要___________ (填“长”或“短”);在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是___________ 。
(3)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。
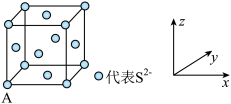
S2-配位数为___________ ;已知图中A处(S2-)的原子分数坐标为(0,0,0),则晶胞中与A距离最近的Cu+的原子分数坐标为___________ ;若晶胞参数anm,晶体的密度为dg·cm-3,则阿伏加德罗常数的值为___________ (用含a和d的式子表示)。
(1)基态铜原子的价电子排布式为
(2)HCOOH中元素电负性从大到小的顺序为
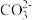 ,
,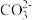 的空间构型为
的空间构型为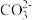 比CH3OH要
比CH3OH要(3)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。

S2-配位数为
您最近一年使用:0次
2023-04-06更新
|
817次组卷
|
3卷引用:四川省自贡市2023届高三下学期第二次诊断性考试理综化学试题
四川省自贡市2023届高三下学期第二次诊断性考试理综化学试题四川省绵阳南山中学2023届高三下学期热身考试理综化学试题(已下线)化学-2023年高考押题预测卷01(全国甲卷)(含考试版、全解全析、参考答案、答题卡)
解题方法
7 . 硫、锌分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。回答下列问题。
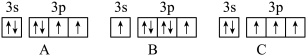
(1)基态硫原子的价电子排布式为___________ ,共有___________ 个未成对电子。下列状态的硫原子中,电离最外层1个电子所需能量最低的是___________ (填标号)。
(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因___________ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有___________ ,下表是2种二烃基锌的沸点数据,则烃基R1是___________ ,推断的依据,是___________ 。
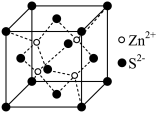
(4)闪锌矿硫化锌的晶胞结构如图所示。硫离子呈立方最密堆积,Zn2+填入S2-组成___________ 空隙中(填“正四面体”或“正八面体”);NA为阿伏加德罗常数,若晶体的密度为ρg/cm3,则S2-离子之间最短核间距离为___________ pm(用含ρ、NA的代数式表示)。
(1)基态硫原子的价电子排布式为

(2)S与O同族,H2S与H2O空间构型相同,都是2对孤电子对,但H2O分子中的键角比H2S分子中的键角大,请从成键电子对之间相互排斥的角度解释其原因
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(°C) | 46 | 118 |

您最近一年使用:0次
2023-03-14更新
|
775次组卷
|
3卷引用:四川省泸州市2023届高三下学期第二次教学质量诊断性考试理综化学试题
名校
解题方法
8 . 生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
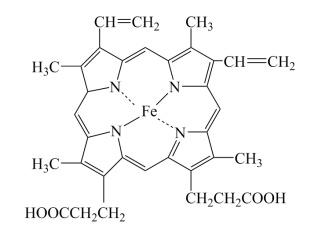
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(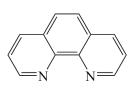 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
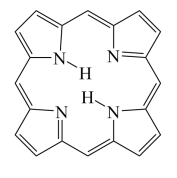
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
您最近一年使用:0次
2023-03-14更新
|
1064次组卷
|
2卷引用:四川省成都市第七中学2023届高三下学期二诊模拟考试理科综合化学试题
解题方法
9 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是_______ ,写出其基态原子的价电子排布式:_______ 。
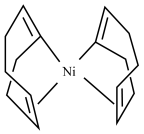
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
①与碳元素同周期且电负性大于碳的元素有_______ 种。
②Ni(cod)2分子内存在的作用力有_______ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为_______ 。
(3)葡萄糖(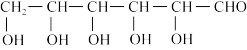 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 _______ 。
(4)下图三种叔醇的沸点从高到低的顺序及原因是_______ 。

(5)红银矿NiAs晶体结构如图所示:
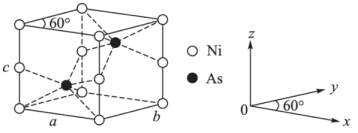
①Ni原子的配位数为_______ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和_______ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为_______ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。

①与碳元素同周期且电负性大于碳的元素有
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为
(3)葡萄糖(
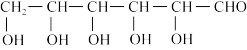 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)下图三种叔醇的沸点从高到低的顺序及原因是

(5)红银矿NiAs晶体结构如图所示:

①Ni原子的配位数为
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.下图为①冰 ②金刚石 ③铜 ④氯化钙 ⑤干冰五种晶体或晶体的晶胞结构:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是_______ 。(用序号填空,下同)
(2)②金刚石 ④ ⑤干冰3种晶体熔点由高到低的顺序为
⑤干冰3种晶体熔点由高到低的顺序为_______ 。
(3)冰的熔点远高于干冰,除 是极性分子、
是极性分子、 是非极性分子外,还有个重要的原因是
是非极性分子外,还有个重要的原因是_______ 。
(4)每个Cu晶胞中实际占有_______ 个Cu原子, 晶体中
晶体中 的配位数为
的配位数为_______ 。
Ⅱ.氮化硅(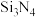 )陶瓷可代替金属制造发动机的耐热部件。工业上用气相沉淀法制备氮化硅:
)陶瓷可代替金属制造发动机的耐热部件。工业上用气相沉淀法制备氮化硅: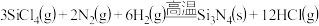 。请回答:
。请回答:
(5)基态N原子的价电子排布图为_______ 。
(6)Si原子与H原子结合时,Si呈正化合价,则电负性:Si_______ H(选填“>”或“<”)。
(7)元素第一电离能:Si_______ N(选填“>”或“<")。
(8)基态Cl原子核外有_______ 种能量不同的电子,其中能量最高的电子所占据的原子轨道呈_______ 形。
(9)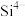 与
与 具有相同的电子构型,
具有相同的电子构型,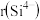 大于
大于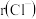 ,原因是
,原因是_______ 。
Ⅲ.锂电池正极材料NCA(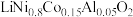 ),极大地改善了锂电池的性能。请回答下列问题:
),极大地改善了锂电池的性能。请回答下列问题:
(10)基态Co原子的价电子排布式为_______ ,电子占据的最高能层的符号为_______ 。
(11)氧化锂( )的熔点为1567℃,氧化镁(MgO)的熔点为2853℃。
)的熔点为1567℃,氧化镁(MgO)的熔点为2853℃。 、
、 的离子半径依次为0.076nm、0.072nm。它们的熔点差异除离子半径因素外,还有
的离子半径依次为0.076nm、0.072nm。它们的熔点差异除离子半径因素外,还有_______ 。
(12) 是有机合成的常用还原剂。阴离子
是有机合成的常用还原剂。阴离子 的立体构型名称为
的立体构型名称为_______ ,其等电子体的化学式为_______ (填一种即可)
(13)NiO晶胞与NaCl晶胞相似,如图所示:

①连接面心上6个 构成
构成_______ (填序号)。
A.正四面体 B.正八面体 C.立方体 D.正四边形
②已知NiO晶胞参数为a pm,NA代表阿伏加德罗常数的值。则NiO晶体的密度为_______  (列出计算式)。
(列出计算式)。
 |  |  |  |  |
| ①冰晶体 | ②金刚石晶体 | ③铜晶胞 | ④氯化钙晶胞 | ⑤干冰晶胞 |
(2)②金刚石 ④
 ⑤干冰3种晶体熔点由高到低的顺序为
⑤干冰3种晶体熔点由高到低的顺序为(3)冰的熔点远高于干冰,除
 是极性分子、
是极性分子、 是非极性分子外,还有个重要的原因是
是非极性分子外,还有个重要的原因是(4)每个Cu晶胞中实际占有
 晶体中
晶体中 的配位数为
的配位数为Ⅱ.氮化硅(
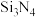 )陶瓷可代替金属制造发动机的耐热部件。工业上用气相沉淀法制备氮化硅:
)陶瓷可代替金属制造发动机的耐热部件。工业上用气相沉淀法制备氮化硅: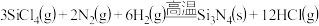 。请回答:
。请回答:(5)基态N原子的价电子排布图为
(6)Si原子与H原子结合时,Si呈正化合价,则电负性:Si
(7)元素第一电离能:Si
(8)基态Cl原子核外有
(9)
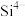 与
与 具有相同的电子构型,
具有相同的电子构型,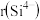 大于
大于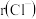 ,原因是
,原因是Ⅲ.锂电池正极材料NCA(
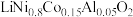 ),极大地改善了锂电池的性能。请回答下列问题:
),极大地改善了锂电池的性能。请回答下列问题:(10)基态Co原子的价电子排布式为
(11)氧化锂(
 )的熔点为1567℃,氧化镁(MgO)的熔点为2853℃。
)的熔点为1567℃,氧化镁(MgO)的熔点为2853℃。 、
、 的离子半径依次为0.076nm、0.072nm。它们的熔点差异除离子半径因素外,还有
的离子半径依次为0.076nm、0.072nm。它们的熔点差异除离子半径因素外,还有(12)
 是有机合成的常用还原剂。阴离子
是有机合成的常用还原剂。阴离子 的立体构型名称为
的立体构型名称为(13)NiO晶胞与NaCl晶胞相似,如图所示:

①连接面心上6个
 构成
构成A.正四面体 B.正八面体 C.立方体 D.正四边形
②已知NiO晶胞参数为a pm,NA代表阿伏加德罗常数的值。则NiO晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-07-10更新
|
190次组卷
|
2卷引用:四川省泸县第一中学2023-2024学年高三上学期开学考试理综化学试题



