解题方法
1 . CO2固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,CO2固定的产物也不同。在戊二酸锌催化下,CO2固定方式主要有:

研究发现,利用氧化锌和戊二酸制备的戊二酸锌的催化效能良好。回答下列问题:
(1)一个基态氧原子的价层电子轨道表示式为_______ ;基态碳原子核外有_______ 个未成对电子。
(2)1mol丁含_______ molσ键,1个丁分子含_______ 个手性碳原子。
(3)乙中所含元素电负性由大到小的顺序为_______ (填元素符号),乙中碳原子的杂化类型是_______ 。
(4)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是_______ 。
(5)配离子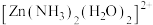 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是_______ 。
(6)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为ρg∙cm-3,NA代表阿伏加德罗常数的值。氧离子的配位数为_______ 。氧和锌的最近距离为_______ nm。


研究发现,利用氧化锌和戊二酸制备的戊二酸锌的催化效能良好。回答下列问题:
(1)一个基态氧原子的价层电子轨道表示式为
(2)1mol丁含
(3)乙中所含元素电负性由大到小的顺序为
(4)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是
(5)配离子
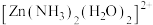 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是(6)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为ρg∙cm-3,NA代表阿伏加德罗常数的值。氧离子的配位数为

您最近一年使用:0次
名校
解题方法
2 . 二茂铁(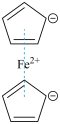 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,Fe变为Fe2+时是失去___________ 轨道电子;若受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态电子排布式:[Ar]___________ 。
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是___________ ,配位原子为___________ 。
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为___________ ;H3O+中氧原子的杂化方式为___________ ,H3O+空间构型为___________ 。
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。

一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次
名校
解题方法
3 . 元素周期表中第四周期过渡元素在工业及生活方面有重要应用。请回答下列问题:
(1)“钛”被称为21世纪金属,画出基态钛的价电子的电子排布图___________ 。
(2)CrO5中Cr为+6价,则-1价的O与-2价的O的个数比为_________ 。
(3)[Co(NH3)4Cl2]+中中心离子的配位数_________ 。能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是_________ (填标号)。
A.浓氨水 B.NaOH溶液 C.稀H2SO4 D.AgNO3溶液
(4)K3[Fe(CN)6]是鉴别Fe2+的重要试剂,这四种元素的电负性从大到小的顺序是_________ (填元素符号),下列碳的杂化为sp的是_________ (填标号)。
A.CH2Cl2 B.C2H2 C.溴苯 D.HCN
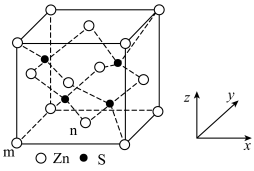
(5)ZnS的晶胞如图所示,若m点坐标为(0,0,0),n点坐标为( ,
, ,0)此晶胞中与n点最远的S的坐标为
,0)此晶胞中与n点最远的S的坐标为___________ 。若晶胞参数为apm,则ZnS的密度为___________ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)“钛”被称为21世纪金属,画出基态钛的价电子的电子排布图
(2)CrO5中Cr为+6价,则-1价的O与-2价的O的个数比为
(3)[Co(NH3)4Cl2]+中中心离子的配位数
A.浓氨水 B.NaOH溶液 C.稀H2SO4 D.AgNO3溶液
(4)K3[Fe(CN)6]是鉴别Fe2+的重要试剂,这四种元素的电负性从大到小的顺序是
A.CH2Cl2 B.C2H2 C.溴苯 D.HCN
(5)ZnS的晶胞如图所示,若m点坐标为(0,0,0),n点坐标为(
 ,
, ,0)此晶胞中与n点最远的S的坐标为
,0)此晶胞中与n点最远的S的坐标为
您最近一年使用:0次
名校
4 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)LiGaH4是一种温和的还原剂,其可由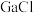 3和过量的LiH反应制得:
3和过量的LiH反应制得: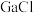 3
3 4
4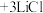 。
。
①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为_______ 。
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:_______ 。
③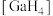 -的立体构型为
-的立体构型为_______ 。
(3)一种含镓的药物合成方法如图所示
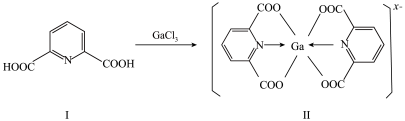
①化合物I中环上N原子的杂化方式为_______ ,1mol化合物Ⅰ中含有的σ键的物质的量为_______ 。化合物I中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为_______ ,x=_______ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:
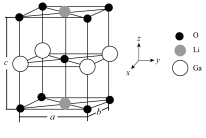
①上述晶胞沿着a轴的投影图为_______ (填选项字母)。
A.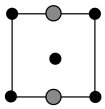 B.
B.  C.
C.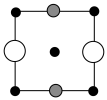
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由
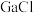 3和过量的LiH反应制得:
3和过量的LiH反应制得: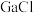 3
3 4
4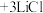 。
。①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
③
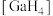 -的立体构型为
-的立体构型为(3)一种含镓的药物合成方法如图所示

①化合物I中环上N原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B.  C.
C.
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为
您最近一年使用:0次
名校
解题方法
5 . 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。
(1)基态碘原子的价电子排布式为___________ 。
(2)CH3NH 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为___________ 。
(3)I 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是___________ (填“sp3”、“sp”、“sp3d”或“sp3d2”)。I 的空间构型为
的空间构型为___________ 。
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是___________ TiCl4至TiI4熔点依次升高,原因是___________ 。
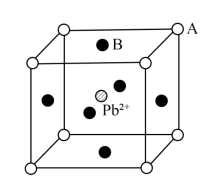
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有___________ 个;晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
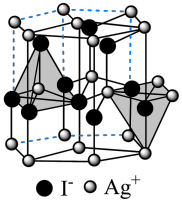
(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能 是___________ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
(1)基态碘原子的价电子排布式为
(2)CH3NH
 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为(3)I
 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是 的空间构型为
的空间构型为
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有

(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因

a.几何因素 b.电荷因素 c.键性因素
您最近一年使用:0次
名校
6 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________ 。
(3)化合物Ⅰ中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物Ⅲ中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为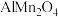 ,其晶胞中铝原子的骨架如图所示。
,其晶胞中铝原子的骨架如图所示。 距离最近的
距离最近的 的个数为
的个数为___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为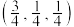 ,原子2的坐标为
,原子2的坐标为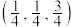 ,则原子3的坐标为
,则原子3的坐标为___________ 。
③已知该晶体属于立方晶系,晶胞参数为a ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为___________  (列出计算式)。
(列出计算式)。

(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为
(3)化合物Ⅰ中碳原子的杂化轨道类型为
(4)化合物Ⅲ中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为
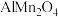 ,其晶胞中铝原子的骨架如图所示。
,其晶胞中铝原子的骨架如图所示。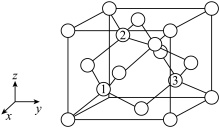
 距离最近的
距离最近的 的个数为
的个数为②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为
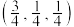 ,原子2的坐标为
,原子2的坐标为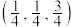 ,则原子3的坐标为
,则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为a
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.锂离子电池是近年来的研究热点,常见的锂离子聚合物电池材料有石墨、LiAsF6、LiPF6、 LiMn2O4等。回答下列问题:
(1)As的价电子排布式为___________ ,Mn在周期表中的位置___________ (周期和族),Li、O、P、As四种元素电负性由大到小的顺序为___________ (填元素符号)。
(2)LiPF6的阴离子中心原子的价层电子对数为___________ 。
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺 制得。三聚氰胺分子中氮原子杂化类型有___________ ;三聚氰胺分子能溶于水,主要原因是___________ 。

Ⅱ.四方ZrO2晶胞如图所示。

(4)Zr4+离子在晶胞中的配位数是___________ ,晶胞参数为a pm、a pm、c pm,该晶体密度为___________ g·cm-3。(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy, 则根据化合价计算y=___________ (用x表达)。
(1)As的价电子排布式为
(2)LiPF6的阴离子中心原子的价层电子对数为
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺 制得。三聚氰胺分子中氮原子杂化类型有

Ⅱ.四方ZrO2晶胞如图所示。

(4)Zr4+离子在晶胞中的配位数是
您最近一年使用:0次
名校
8 . 某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是___________(填字母)。
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,从电子云重叠方式判断AsCl3中的化学键属于___________ 键;砷酸的酸性弱于硒酸,从分子结构的角度解释原因___________ 。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为___________ ,画出配离子的结构式___________ (不考虑立体构型)。
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为___________ 。
②已知 CrO5中铬元素为最高价态,氧元素有 价和
价和 价,画出其结构式:
价,画出其结构式:___________ 。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如下图所示,则碳化钨的化学式为___________ ,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是___________ g·cm-3(列出计算表达式)。

(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是___________(填字母)。
| A.①②③ | B.③①② | C.③②① | D.①③② |
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,从电子云重叠方式判断AsCl3中的化学键属于
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为
②已知 CrO5中铬元素为最高价态,氧元素有
 价和
价和 价,画出其结构式:
价,画出其结构式:③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如下图所示,则碳化钨的化学式为

您最近一年使用:0次
名校
解题方法
9 . 铁及其化合物在生活、生产中有重要应用。回答下列问题:
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是___________ 。
②乳酸分子(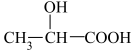 )中σ键与π键的数目比为
)中σ键与π键的数目比为___________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为___________ 。
④C与O中,第一电离能较大的是___________ ,O的第二电离能远大于第一电离能的原因是___________ 。
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为___________ 。
②NH3的空间构型是___________ ,其中N原子的杂化方式是___________ 。
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图所示。
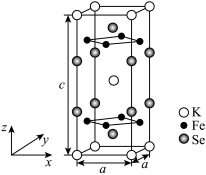
①该超导材料的化学式是___________ 。
②该晶胞参数a=0.4nm、c=1.4nm,该晶体密度ρ=___________ g·cm-3(用NA表示阿伏加德罗常数,写出计算表达式即可)。
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是
②乳酸分子(
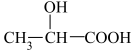 )中σ键与π键的数目比为
)中σ键与π键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
④C与O中,第一电离能较大的是
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为
②NH3的空间构型是
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图所示。

①该超导材料的化学式是
②该晶胞参数a=0.4nm、c=1.4nm,该晶体密度ρ=
您最近一年使用:0次
名校
解题方法
10 . 高温乃至室温超导一直是科学家不懈追求目标。科学家合成了一种高温超导材料,其晶胞结构如图所示(B和C原子均位于晶胞面上),该立方晶胞参数为apm。
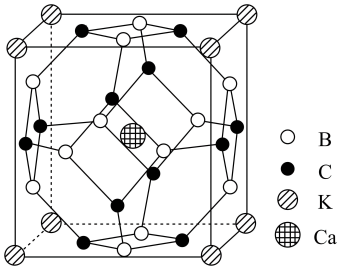
(1)该晶体的四种元素的电负性由大到小的顺序是___________ 。钙元素的焰色实验为砖红色,基于其原理可用于定性与定量分析,这种分析方法称为___________ 光谱。
(2)该晶体中,B原子的杂化轨道类型是_______ ,C原子的杂化轨道类型是________ 。
(3)该晶体中微粒间存在的化学键有_________ 、___________ 。
(4)该晶体的化学式为________ (化成最简整数比),密度为_________  (列出计算式,相对分子质量用M表示无需计算出数值)。
(列出计算式,相对分子质量用M表示无需计算出数值)。
(5)晶胞中B和C原子构成的多面体有_________ 个面
(6)比较 与
与 的沸点并解释原因
的沸点并解释原因_________ ;比较 与
与 的键角并解释原因
的键角并解释原因___________ 。

(1)该晶体的四种元素的电负性由大到小的顺序是
(2)该晶体中,B原子的杂化轨道类型是
(3)该晶体中微粒间存在的化学键有
(4)该晶体的化学式为
 (列出计算式,相对分子质量用M表示无需计算出数值)。
(列出计算式,相对分子质量用M表示无需计算出数值)。(5)晶胞中B和C原子构成的多面体有
(6)比较
 与
与 的沸点并解释原因
的沸点并解释原因 与
与 的键角并解释原因
的键角并解释原因
您最近一年使用:0次



