名校
解题方法
1 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,现利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
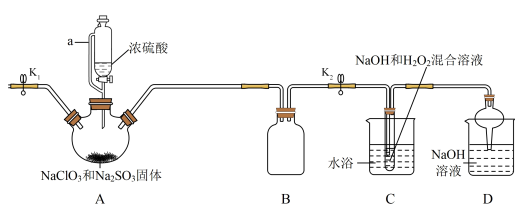
(1)A装置中仪器a的名称为______ 。装置D中NaOH溶液的作用是______ 。
(2)装置A中生成ClO2的化学方程式为______ 。
(3)关于装置C及后续操作的下列说法中,错误的是______ 。
(4)仪器A中NaClO3需稍微过量,原因是______ 。
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是______ 。
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是______ ;Cl2O键角比F2O键角______ (填“大”“小”或“相等”)。
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为______ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)关于装置C及后续操作的下列说法中,错误的是
| A.装置C中H2O2作氧化剂 |
| B.为获得NaClO2晶体,可将C试管中的溶液在55℃蒸发浓缩结晶并趁热过滤 |
| C.用50℃左右温水洗涤所得晶体 |
| D.高温烘干过滤后所得滤渣即可得到产物 |
(4)仪器A中NaClO3需稍微过量,原因是
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为
您最近半年使用:0次
2023-10-27更新
|
1042次组卷
|
5卷引用:广西部分高中2024届高三第一次摸底测试化学试题
广西部分高中2024届高三第一次摸底测试化学试题广西南宁市2024届高三上学期毕业班摸底测试化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
2 . 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。
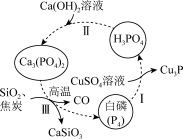
下列说法不正确 的是

下列说法
A. 的空间结构为正四面体形 的空间结构为正四面体形 |
| B.流程中所涉及元素的基态原子未成对电子数最多的是P |
| C.过程I、II、III中发生的均为氧化还原反应 |
| D.过程I中,氧化产物与还原产物的物质的量之比为6:5 |
您最近半年使用:0次
解题方法
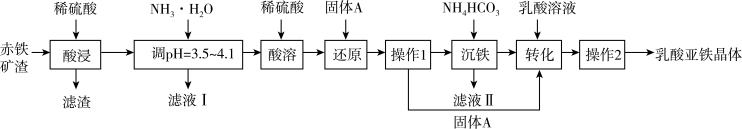
3 . 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe•3H2O}几乎不溶于乙醇,易被氧化。以赤铁矿渣(主要成分是Fe2O3,含少量Al2O3、SiO2杂质)和乳酸[CH3CH(OH)COOH]为原料制取乳酸亚铁晶体的工艺如图所示:
已知:
回答下列问题:
(1)C、N、O的一第电离能由大到小的顺序为___________ ,H2O的中心原子的孤电子对数为___________ 。
(2)常温下,调pH=3.5~4.1的目的是___________ 。
(3)“沉铁”过程的离子方程式为___________ 。
(4)“操作2”具体为:隔绝空气低温蒸发浓缩、___________ 、冷却结晶、过滤、乙醇洗涤、真空干燥,密封储存产品。乙醇洗涤的目的是___________ 。
(5)可用高锰酸钾滴定法测定样品中Fe2+的量,进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________ :经查阅文献后,小组同学改用Ce(SO4)2标准溶液滴定法进行测定。反应中Ce4+的还原产物为Ce3+。测定时称取3.0g样品溶于水,配成100mL溶液,每次取20mL的溶液用0.100mol•L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
则产品中乳酸亚铁晶体的纯度为___________ 。

已知:
| 金属氢氧化物 | 溶度积Ksp | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 2×10-32 | 4.1 | 5.4 |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.4 |
回答下列问题:
(1)C、N、O的一第电离能由大到小的顺序为
(2)常温下,调pH=3.5~4.1的目的是
(3)“沉铁”过程的离子方程式为
(4)“操作2”具体为:隔绝空气低温蒸发浓缩、
(5)可用高锰酸钾滴定法测定样品中Fe2+的量,进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是
| 滴定序号 | 0.100mol•L-1Ce(SO4)2标准溶液体积/mL | |
| 滴定前读数 | 滴定后读数 | |
| 1 | 0.10 | 19.85 |
| 2 | 0.12 | 21.32 |
| 3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为
您最近半年使用:0次
2021-06-15更新
|
781次组卷
|
4卷引用:辽宁省阜新二高2021届高三下学期第六次模拟考试化学试题
辽宁省阜新二高2021届高三下学期第六次模拟考试化学试题(已下线)微专题33 化学工艺流程题——物质的分离与提纯-备战2022年高考化学考点微专题2021年湖南省高考化学试卷变式题11-19(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)



