解题方法
1 . 《科学》杂志发表了中国科学家的原创性重大突破——首次在实验室实现CO2到淀粉的合成的文章,其合成路线如图所示,下列说法正确的是


| A.淀粉分子中含有π键 |
B. 的空间结构为平面三角形 的空间结构为平面三角形 |
C.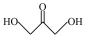 为手性分子。 为手性分子。 |
| D.HCHO中键角:∠OCH大于∠HCH |
您最近半年使用:0次
解题方法
2 . 液态的 可作制冷剂,
可作制冷剂, 还可用于制造铵态(
还可用于制造铵态( )氮肥和硝态(
)氮肥和硝态( )氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在
)氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在 Pa、550°C的条件下以
Pa、550°C的条件下以 和
和 为原料合成了
为原料合成了 :
:
 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。下列有关
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。下列有关 、
、 、
、 说法
说法不正确 的是
 可作制冷剂,
可作制冷剂, 还可用于制造铵态(
还可用于制造铵态( )氮肥和硝态(
)氮肥和硝态( )氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在
)氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在 Pa、550°C的条件下以
Pa、550°C的条件下以 和
和 为原料合成了
为原料合成了 :
:
 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。下列有关
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。下列有关 、
、 、
、 说法
说法| A.液氨分子间存在氢键 | B. 的空间构型为正四面体型 的空间构型为正四面体型 |
C. 和 和 中的键角相等 中的键角相等 | D. 和 和 中N原子杂化方式不同 中N原子杂化方式不同 |
您最近半年使用:0次
解题方法
3 . 氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________ ,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________ 。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________ 。
(3)N2F2分子中N原子的杂化方式是__________ ,l mol N2F2含有__________ molσ键.
(4)NF3的键角__________ NH3的键角(填“<”“>”或“=”),原因是__________ .
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________ mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________ .
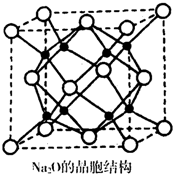
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为__________ ,Na2O晶体的密度为__________ g•cm-3(只要求列算式,不必计算出结果)。
(1)基态N原子中电子在2p轨道上的排布遵循的原则是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)N2F2分子中N原子的杂化方式是
(4)NF3的键角
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4
(6)安全气囊的设计原理为6NaN3+FeIO3
 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为

您最近半年使用:0次
名校
解题方法
4 . 物质的光学性质在科研中有重要的用途。回答下列问题:
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
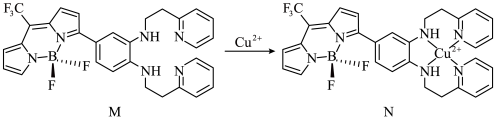
(1)H、C、N、F四种元素电负性由大到小的顺序为___________ ,M中键角F-B-F___________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为___________ 。
(2)均为平面结构的吡咯(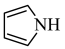 )和吡啶(
)和吡啶(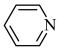 )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为___________ ,原因是___________ 。
Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
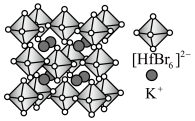
(3)该晶胞中 的配位数为
的配位数为___________ ,阴离子形成的八面体空隙有___________ 个。
(4)该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为___________ nm。
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:

(1)H、C、N、F四种元素电负性由大到小的顺序为
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。

(3)该晶胞中
 的配位数为
的配位数为(4)该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为
您最近半年使用:0次
2024-04-08更新
|
944次组卷
|
3卷引用:山东省烟台市2024届高三一模化学试题
解题方法
5 . VIA族的氧、硫、硒(Se)、碲(Te)等元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)基态O原子中,未成对电子数与成对电子数之比为_______ 。
(2)亚硫酰氯 在有机合成中有重要应用,分子中S原子的杂化轨道类型为
在有机合成中有重要应用,分子中S原子的杂化轨道类型为_______ ,分子的空间结构为_______ 。
(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是_______ , 、
、 和
和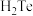 键角最小的是
键角最小的是_______ ,稳定性最强的是_______ 。
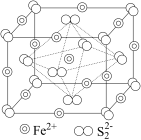
(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为_______ , 的配位数为
的配位数为_______ ,晶体的密度为_______  ,在1个晶胞中,由
,在1个晶胞中,由 围成的正八面体的个数为
围成的正八面体的个数为_______ 。
(1)基态O原子中,未成对电子数与成对电子数之比为
(2)亚硫酰氯
 在有机合成中有重要应用,分子中S原子的杂化轨道类型为
在有机合成中有重要应用,分子中S原子的杂化轨道类型为(3)气态电中性基态原子得到一个电子转化为气态基态负离子所放出的能量叫做第一电子亲和能。S、Se、Te三种元素的第一电子亲和能由大到小的顺序是
 、
、 和
和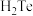 键角最小的是
键角最小的是(4)黄铁矿是工业生产硫酸的原料,其晶胞结构如图所示,晶胞参数为anm,该晶体的电子式为
 的配位数为
的配位数为 ,在1个晶胞中,由
,在1个晶胞中,由 围成的正八面体的个数为
围成的正八面体的个数为
您最近半年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH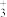 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)
①四种微粒中,键角为120°的是___________ (填序号)。
②碳负离子(CH )的空间构型为
)的空间构型为___________ ,与(CH )互为等电子体的一种分子是
)互为等电子体的一种分子是___________ (填化学式)。
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为___________ 。
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为___________ ;1 mol尿素分子中,σ 键的数目为___________ 。
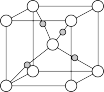
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为___________ g·cm-3。
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH
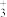 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)①四种微粒中,键角为120°的是
②碳负离子(CH
 )的空间构型为
)的空间构型为 )互为等电子体的一种分子是
)互为等电子体的一种分子是(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为

您最近半年使用:0次
7 . 研究发现,在CO2低压合成甲醇的反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,Mn(NO3)2是制备该催化剂的原料之一。
(1)Co基态原子核外电子排布式为__________ 。
(2)C、N、O三种元素的电负性由大到小的顺序是_________ , 中,N原子的杂化方式为
中,N原子的杂化方式为________ ,写出一种与 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:__________ 。
(3)CO2分子中,σ键和π键的数目之比为________ 。
(4)H2O的沸点高于CO2的原因是__________ 。
(1)Co基态原子核外电子排布式为
(2)C、N、O三种元素的电负性由大到小的顺序是
 中,N原子的杂化方式为
中,N原子的杂化方式为 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(3)CO2分子中,σ键和π键的数目之比为
(4)H2O的沸点高于CO2的原因是
您最近半年使用:0次
名校
解题方法
8 . 工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2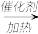 CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述
CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述错误 的是
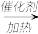 CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述
CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述| A.H2O分子VSEPR模型为V形 |
| B.CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为sp3 |
| C.在上述涉及的4种物质中,沸点从低到高的顺序为H2<CO< H2O<CH3CH2OH |
| D.CO(NH2)2分子中含有的σ键与π键的数目之比为7:1 |
您最近半年使用:0次
2020-04-16更新
|
177次组卷
|
4卷引用:广东省揭阳市2020届高三下学期线上教学摸底测试化学(理)试题
名校
解题方法
9 . 合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用[Cu(NH3)2]Ac [醋酸二氨合铜(Ⅰ)]溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3]Ac
[Cu(NH3)3]Ac
⑴配合物[Cu(NH3)2]Ac中,中心离子的基态价电子排布式为_______ 。
(2)醋酸根离子中碳原子轨道杂化类型为__________ 。
(3)1mol 配离子[Cu(NH3)3CO]+中σ键和π键的数目之比为______ 。
(4)NH3的空间构型是___ (用文字描述):与CO互为等电子体的阴离子可以是____ 。
(要求:由题中涉及的元素原子构成,用电子式表示)。
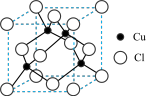
(5)铜的化合物种类很多,下图是某铜的氯化物的晶胞结构,该氯化物能溶于浓氨水可得无色溶液(配合物中配位数为2),请完成有关反应的离子方程式:______ 。
 [Cu(NH3)3]Ac
[Cu(NH3)3]Ac⑴配合物[Cu(NH3)2]Ac中,中心离子的基态价电子排布式为
(2)醋酸根离子中碳原子轨道杂化类型为
(3)1mol 配离子[Cu(NH3)3CO]+中σ键和π键的数目之比为
(4)NH3的空间构型是
(要求:由题中涉及的元素原子构成,用电子式表示)。
(5)铜的化合物种类很多,下图是某铜的氯化物的晶胞结构,该氯化物能溶于浓氨水可得无色溶液(配合物中配位数为2),请完成有关反应的离子方程式:

您最近半年使用:0次



