解题方法
1 . 对于由短周期元素形成的分子,下表所述的对应关系错误的是
| 选项 | A | B | C | D |
| 分子式 | CCl4 | PH3 | CO2 | SCl2 |
| VSEPR模型 | 正四面体形 | 四面体形 | 直线形 | 四面体形 |
| 分子的立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2018高三上·全国·专题练习
名校
解题方法
2 . 对于短周期元素形成的各分子,下表所述的对应关系错误的是
| 选项 | A | B | C | D |
| 分子式 | CH4 | NH3 | CO2 | SCl2 |
| VSEPR模型 | 正四面体形 | 四面体形 | 直线形 | 四面体形 |
| 分子的立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2018-12-03更新
|
540次组卷
|
6卷引用:2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式
(已下线)2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)广东省深圳市福田区外国语高级中学2022-2023学年高三上学期第二次调研考试化学试题广东省广州市海珠外国语实验中学2022-2023学年高三上学期第三次阶段性(期中)考试化学试题
名校
解题方法
3 . 物质的光学性质在科研中有重要的用途。回答下列问题:
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
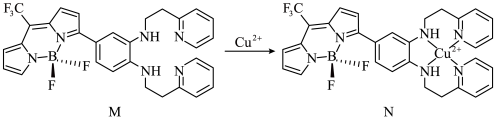
(1)H、C、N、F四种元素电负性由大到小的顺序为___________ ,M中键角F-B-F___________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为___________ 。
(2)均为平面结构的吡咯(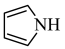 )和吡啶(
)和吡啶(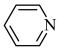 )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为___________ ,原因是___________ 。
Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
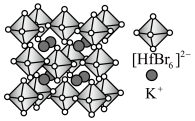
(3)该晶胞中 的配位数为
的配位数为___________ ,阴离子形成的八面体空隙有___________ 个。
(4)该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为___________ nm。
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:

(1)H、C、N、F四种元素电负性由大到小的顺序为
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。

(3)该晶胞中
 的配位数为
的配位数为(4)该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为
您最近半年使用:0次
2024-04-08更新
|
944次组卷
|
3卷引用:山东省烟台市2024届高三一模化学试题
名校
解题方法
4 . 根据所学内容填空:
(1)有下列物质:①HF、②Cl2、③H2O、④CCl4、⑤BF3、⑥CO2,其中属于极性分子的是_______ (填序号,下同),既有 键又有
键又有 键的是
键的是_______ 。
(2)下列分子中,空间构型为正四面体且键角为 的是
的是_______ 。
a. b.
b. c.
c.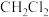 d.
d. e.
e. f.
f.
(3)H2O、 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是____ 。
(4)丙烯晴分子( )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为_______ 。
(5)VIA族元素氧、硫、硒( )的化合物在研究和生产中有许多重要用途。
)的化合物在研究和生产中有许多重要用途。
① 离子的空间构型为
离子的空间构型为_______ 。
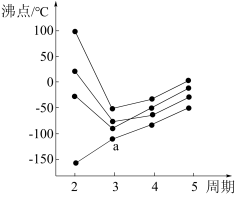
②如图所示,每条折线表示周期表IVA—VIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ (化学式)
(1)有下列物质:①HF、②Cl2、③H2O、④CCl4、⑤BF3、⑥CO2,其中属于极性分子的是
 键又有
键又有 键的是
键的是(2)下列分子中,空间构型为正四面体且键角为
 的是
的是a.
 b.
b. c.
c.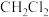 d.
d. e.
e. f.
f.
(3)H2O、
 、
、 、
、 的气态分子中,中心原子价层电子对数不同于其他分子的是
的气态分子中,中心原子价层电子对数不同于其他分子的是(4)丙烯晴分子(
 )中碳原子杂化轨道类型为
)中碳原子杂化轨道类型为(5)VIA族元素氧、硫、硒(
 )的化合物在研究和生产中有许多重要用途。
)的化合物在研究和生产中有许多重要用途。①
 离子的空间构型为
离子的空间构型为②如图所示,每条折线表示周期表IVA—VIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

您最近半年使用:0次
解题方法
5 . 钙是一种重要的化学元素,钙在地壳中含量较高且在多方面有着广泛的用途。回答下列问题:
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、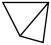 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是___________ ,石膏中层与层之间的作用力主要是___________ 。

(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA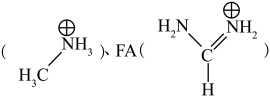 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是___________ ,1molFA中存在___________ 个 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。
(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为___________ ,同周期元素中与其最外层电子数相同的元素为___________ (填元素符号)。
②图a晶胞中O的位置为___________ (填“体心”“顶点”“面心”“棱心”,下同);图b晶胞中O的位置为___________ 。图a的晶胞参数为393.9pm,则O与O的最小核间距为___________ pm(写出表达式)。
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、
 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是
(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA
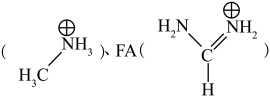 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为
②图a晶胞中O的位置为
您最近半年使用:0次
解题方法
6 . 磷、硼及其化合物用途非常广泛。回答下列问题:
(1)镍的一种配合物为 ,Ph表示苯基。
,Ph表示苯基。
①基态Ni原子价电子排布式为___________ ;镍在周期表中位于第___________ 周期第___________ 族。
②配体为___________ ; 分子中含σ键数为
分子中含σ键数为___________ 个。
(2) 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应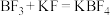 制备。
制备。
① 中阴离子空间构型为
中阴离子空间构型为___________ ,该物质中含有的化学键类型有___________ (填字母)
A.离子键 B.共价键 C.配位键 D.氢键
② 分子的B-F键间的键角比
分子的B-F键间的键角比 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是___________ 。
(3)磷化硼是一种半导体材料,密度为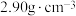 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于___________ 晶体;其晶胞参数a=___________ nm(列出计算式)。

(1)镍的一种配合物为
 ,Ph表示苯基。
,Ph表示苯基。①基态Ni原子价电子排布式为
②配体为
 分子中含σ键数为
分子中含σ键数为(2)
 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应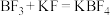 制备。
制备。①
 中阴离子空间构型为
中阴离子空间构型为A.离子键 B.共价键 C.配位键 D.氢键
②
 分子的B-F键间的键角比
分子的B-F键间的键角比 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是(3)磷化硼是一种半导体材料,密度为
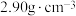 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
您最近半年使用:0次
名校
7 . Ⅰ.硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。
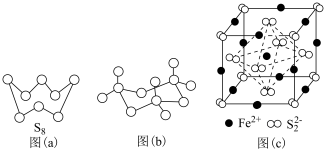
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为______
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是______ 。
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是______ 。
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是______ 。
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为______ 。
(9)NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式。下同)。还原性由强到弱的顺序为______ 。键角由大到小的顺序为______ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为
(9)NH3、PH3、AsH3的沸点由高到低的顺序为
您最近半年使用:0次
2024-01-15更新
|
144次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期12月月考化学试题
解题方法
8 . 硼、钾和硒( )在化工行业中有重要用途,请回答下列问题。
)在化工行业中有重要用途,请回答下列问题。
(1)X是一种抗癌新药,其结构如下:
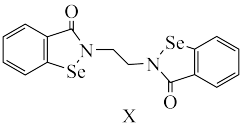
①硒元素的基态原子核外电子排布式为_______ 。
②关于化合物X,下列说法正确的是_______ 。
A.碳、硒元素的杂化方式均为
B.元素电负性大小
C.能量最低的激发态 原子的电子排布式:
原子的电子排布式:
D.该新药中有8种不同化学环境的碳
(2)氨硼烷( )具有良好的储氢能力,分子中有配位键。则氨硼烷中
)具有良好的储氢能力,分子中有配位键。则氨硼烷中 的键角
的键角___________ (填“>”“<”或“=”)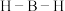 的键角,理由是
的键角,理由是___________ 。
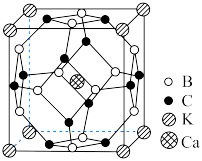
(3)某化合物晶体晶胞结构如图所示,该立方晶胞边长为 。该晶体中与
。该晶体中与 最近且距离相等的
最近且距离相等的 有
有___________ 个,晶体的密度为_______  (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
 )在化工行业中有重要用途,请回答下列问题。
)在化工行业中有重要用途,请回答下列问题。(1)X是一种抗癌新药,其结构如下:

①硒元素的基态原子核外电子排布式为
②关于化合物X,下列说法正确的是
A.碳、硒元素的杂化方式均为

B.元素电负性大小

C.能量最低的激发态
 原子的电子排布式:
原子的电子排布式:
D.该新药中有8种不同化学环境的碳
(2)氨硼烷(
 )具有良好的储氢能力,分子中有配位键。则氨硼烷中
)具有良好的储氢能力,分子中有配位键。则氨硼烷中 的键角
的键角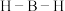 的键角,理由是
的键角,理由是(3)某化合物晶体晶胞结构如图所示,该立方晶胞边长为
 。该晶体中与
。该晶体中与 最近且距离相等的
最近且距离相等的 有
有 (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近半年使用:0次
名校
解题方法
9 . 氮(N)形成的单质及它形成的化合物有重要的研究和应用价值,回答下列问题:
(1)已知NO 与CO2互为等电子体,NO
与CO2互为等电子体,NO 的结构式为
的结构式为_______ ,中心原子N的杂化方式为_______ 。
(2)NH4BF4(四氟硼酸铵)可用作铝或铜的焊接助熔剂,能腐蚀玻璃,有重要的化工用途。下列说法正确的是________ 。
(3)向硫酸铜溶液中通入过量氨气,得到深蓝色溶液,生成配合物[Cu(NH3)4]SO4,其中1mol阳离子[Cu(NH3)4]2+中含有σ键数目为________ 。向该深蓝色溶液中加入乙醇,得到深蓝色晶体,该深蓝色晶体为________ (填化学式)。
(4)请从结构角度解释HNO3的酸性比HNO2强的原因________ 。
(1)已知NO
 与CO2互为等电子体,NO
与CO2互为等电子体,NO 的结构式为
的结构式为(2)NH4BF4(四氟硼酸铵)可用作铝或铜的焊接助熔剂,能腐蚀玻璃,有重要的化工用途。下列说法正确的是
| A.核素15N的中子数为7 | B.F元素位于元素周期表p区 |
C.BF 的空间构型为正四面体形 的空间构型为正四面体形 | D.NH4BF4中存在离子键、共价键、氢键和范德华力 |
(4)请从结构角度解释HNO3的酸性比HNO2强的原因
您最近半年使用:0次
名校
解题方法
10 . 水合硫酸四氨合铜[Cu(NH3)4(H2O)2]SO4在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述正确的是
A.[Cu(NH3)4(H2O)2]SO4中 的空间构型为平面三角型 的空间构型为平面三角型 |
| B.[Cu(NH3)4(H2O)2]2+中存在离子键、配位键和极性共价键 |
| C.NH3分子中H-N-H键的角小于H2O分子中H-O-H键的健角 |
| D.NH3和H2O与Cu2+的配位能力:NH3>H2O |
您最近半年使用:0次



