2018高三上·全国·专题练习
名校
解题方法
1 . 对于短周期元素形成的各分子,下表所述的对应关系错误的是
| 选项 | A | B | C | D |
| 分子式 | CH4 | NH3 | CO2 | SCl2 |
| VSEPR模型 | 正四面体形 | 四面体形 | 直线形 | 四面体形 |
| 分子的立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-03更新
|
542次组卷
|
6卷引用:2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式
(已下线)2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)广东省深圳市福田区外国语高级中学2022-2023学年高三上学期第二次调研考试化学试题广东省广州市海珠外国语实验中学2022-2023学年高三上学期第三次阶段性(期中)考试化学试题
解题方法
2 . 对于由短周期元素形成的分子,下表所述的对应关系错误的是
| 选项 | A | B | C | D |
| 分子式 | CCl4 | PH3 | CO2 | SCl2 |
| VSEPR模型 | 正四面体形 | 四面体形 | 直线形 | 四面体形 |
| 分子的立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是___ ;

(2)Se原子的原子序数为___ ,基态电子的排布式为[Ar]___ ;
(3)H2Se的稳定性比H2S___ (填“强”或“弱”)。SeO3分子的立体构型为___ 。
(4)下列分子中含手性碳的是___ 。
a. b.
b.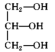 c.
c. d.CH3CHClCH2CHO
d.CH3CHClCH2CHO
(5)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因___ ;氮元素的E1呈现异常的原因是___ 。

(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是

(2)Se原子的原子序数为
(3)H2Se的稳定性比H2S
(4)下列分子中含手性碳的是
a.
 b.
b. c.
c. d.CH3CHClCH2CHO
d.CH3CHClCH2CHO(5)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因

您最近一年使用:0次
解题方法
4 . 碳是形成单质和化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳有多种单质,其中石墨烯与金刚石的晶体结构如图所示:
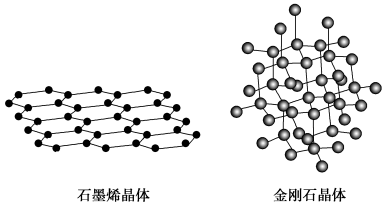
石墨烯能导电而金刚石不能导电的原因是________ 。
(2)碳的主要氧化物有CO和CO2
①CO能与金属Fe形成一种浅黄色液体Fe(CO)5,其熔点为-20℃,沸点为103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。据此判断:该化合物的晶体中不涉及 的作用力有________ 。
A.离子键 B.极性键 C.非极性键 D.范德华力 E.配位键
②CO2在一定条件下可以合成甲醇,反应方程式为: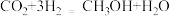 。该反应所涉及的4种物质,沸点从高到低的顺序为
。该反应所涉及的4种物质,沸点从高到低的顺序为________ 。
(3) 是重要的有机反应中间体,其空间构型为
是重要的有机反应中间体,其空间构型为________ 。
(4)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。
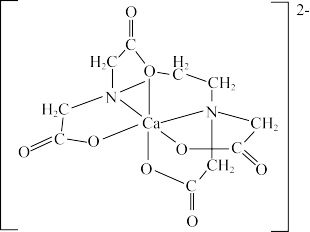
①钙离子的配位数是________ 。
②配体中碳原子的杂化方式有________ 。
(1)碳有多种单质,其中石墨烯与金刚石的晶体结构如图所示:

石墨烯能导电而金刚石不能导电的原因是
(2)碳的主要氧化物有CO和CO2
①CO能与金属Fe形成一种浅黄色液体Fe(CO)5,其熔点为-20℃,沸点为103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。据此判断:该化合物的晶体中
A.离子键 B.极性键 C.非极性键 D.范德华力 E.配位键
②CO2在一定条件下可以合成甲醇,反应方程式为:
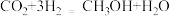 。该反应所涉及的4种物质,沸点从高到低的顺序为
。该反应所涉及的4种物质,沸点从高到低的顺序为(3)
 是重要的有机反应中间体,其空间构型为
是重要的有机反应中间体,其空间构型为(4)碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。

①钙离子的配位数是
②配体中碳原子的杂化方式有
您最近一年使用:0次
名校
解题方法
5 . 硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:________ 。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是__________ 。
(3)BF3分子中中心原子的杂化轨道类型是____ 。又知若有d轨道参与杂化,能大大提高中心原子的成键能力,分析BF3、SiF4水解的产物中, 除了相应的酸外,前者生成BF4-而后者生成SiF62-的原因:_______________ 。
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为_________ ,其中三种元素的电负性由大到小的顺序是_______________ 。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]•8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是______________ (填字母)。

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
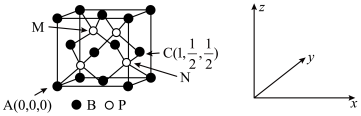
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的_____ (填“立方体”“正四面体”或“正八面体”)空隙。建立如图所示坐标系,可得晶胞中A、C处原子的分数坐标,则N处的P原子分数坐标为______ 。若晶胞中硼原子和磷原子之间的最近核间距为a pm,则晶胞边长为____________ cm。
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式:
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是
(3)BF3分子中中心原子的杂化轨道类型是
(4)NaBH4被认为是有机化学中的“万能还原剂”,NaBH4的电子式为
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个B(OH)4]-(合而成的双六元环,应该写成 Na2[B4O5(OH)4]•8H2O,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是

A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
(6)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的

您最近一年使用:0次
2020-04-09更新
|
195次组卷
|
2卷引用:重庆巴蜀中学高2020届高三下学期3月月月考理综化学试题
解题方法
6 . 硫、氮、磷等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为________ 。
(2)常见含硫的物质有 ,
, ,
, ,该三种物质中熔点最高的是
,该三种物质中熔点最高的是________ (填化学式)。
(3)将过量的 通入
通入 溶液中可以得到
溶液中可以得到 ,
, 中第一电离能最大的是
中第一电离能最大的是________ (填元素符号)。 、
、 和
和 的价电子对数均为4,但键角不同,其原因是
的价电子对数均为4,但键角不同,其原因是________ 。
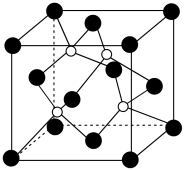
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应得到。磷化硼晶体的晶胞结构如图所示,该晶胞中含有________ 个B原子。已知该晶胞的边长为 ,设阿伏加 德罗常数的值为
,设阿伏加 德罗常数的值为 ,则磷化硼晶体的密度为
,则磷化硼晶体的密度为________  。
。
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为
(2)常见含硫的物质有
 ,
, ,
, ,该三种物质中熔点最高的是
,该三种物质中熔点最高的是(3)将过量的
 通入
通入 溶液中可以得到
溶液中可以得到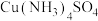 ,
,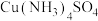 中第一电离能最大的是
中第一电离能最大的是 、
、 和
和 的价电子对数均为4,但键角不同,其原因是
的价电子对数均为4,但键角不同,其原因是(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应得到。磷化硼晶体的晶胞结构如图所示,该晶胞中含有
 ,设阿伏加 德罗常数的值为
,设阿伏加 德罗常数的值为 ,则磷化硼晶体的密度为
,则磷化硼晶体的密度为 。
。
您最近一年使用:0次
2020-07-15更新
|
113次组卷
|
2卷引用:山东省2019-2020学年高二下学期第二次联合考试化学试题
名校
解题方法
7 . 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__ 。
(2)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__ 形,其中共价键的类型有___ 种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为___ 。

| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

您最近一年使用:0次
解题方法
8 . 铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO ⇌ [Cu(NH3)3CO]+,2CH3COOH +2CH2=CH2+O2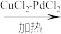 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为______ 。
(2)NH3分子空间构型为_______ , 其中心原子的杂化类型是______ 。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_______ ,1mol CH3COOCH=CH2中含 键数目为
键数目为_____ 。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为__________ 。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构示意图表示为____
 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。(1)Cu2+基态核外电子排布式为
(2)NH3分子空间构型为
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是
 键数目为
键数目为(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构示意图表示为
您最近一年使用:0次
名校
解题方法
9 . 铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)CuSO4晶体中 S 原子的杂化方式为________ , 的立体构型为
的立体构型为 ___________ 。
(2)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为___________________ 。N、O、S 三种元素的第一电离能大小顺序为 _________________ (填元素符号)。
②向 CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是______ 。
A.NH3分子和H2O 分子均为极性分子但中心原子杂化类型不一样;
B.NH3分子和H2O 分子,分子空间构型不同,氨气分子的键角小于水分子的键角;
C.Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体;
D.已知 3.4 g 氨气在氧气中完全燃烧生成无污染的气体,并放出 a kJ 热量,则 NH3的燃烧热的热化学方程式为:NH3 (g)+3/4O 2(g)=1/2N2 (g)+3/2H2O(g) ΔH=-5a kJ•mol-1
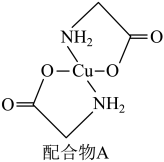
(3)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物 A,其结构如下图所示。
①氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:______________ (写化学式)。
②1 mol 氨基乙酸钠(H2NCH2COONa)含有σ键的数目为_____________ 。(NA为阿伏加 德罗常数的值)
③该结构中,除共价键外还存在配位键,请在图中用“→”表示出配位键_____________ 。
(1)CuSO4晶体中 S 原子的杂化方式为
 的立体构型为
的立体构型为 (2)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为
②向 CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是
A.NH3分子和H2O 分子均为极性分子但中心原子杂化类型不一样;
B.NH3分子和H2O 分子,分子空间构型不同,氨气分子的键角小于水分子的键角;
C.Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体;
D.已知 3.4 g 氨气在氧气中完全燃烧生成无污染的气体,并放出 a kJ 热量,则 NH3的燃烧热的热化学方程式为:NH3 (g)+3/4O 2(g)=1/2N2 (g)+3/2H2O(g) ΔH=-5a kJ•mol-1
(3)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物 A,其结构如下图所示。

①氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:
②1 mol 氨基乙酸钠(H2NCH2COONa)含有σ键的数目为
③该结构中,除共价键外还存在配位键,请在图中用“→”表示出配位键
您最近一年使用:0次
名校
解题方法
10 . 非金属及其化合物在生产、生活中应用广泛。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1)CO2的电子式是______ ,包含的化学键类型为______ 共价键(填“非极性”或“极性”)。
(2)在温度高于31.26 oC、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有______ (答出一点即可)。
Ⅱ.氯水以及氯的化合物经常用于饮用水的消毒。
(3)将铁片插入盛有少量新制氯水的试管中,无气泡产生,用长滴管吸取KSCN溶液滴入铁片附近,溶液变红色,然后红色消失。显红色的离子方程式为______ 。
(4)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为___________ 。
②亚硫酸钠将水中多余次氯酸除去的反应的化学方程式为_______________ 。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1)CO2的电子式是
(2)在温度高于31.26 oC、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有
Ⅱ.氯水以及氯的化合物经常用于饮用水的消毒。
(3)将铁片插入盛有少量新制氯水的试管中,无气泡产生,用长滴管吸取KSCN溶液滴入铁片附近,溶液变红色,然后红色消失。显红色的离子方程式为
(4)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为
②亚硫酸钠将水中多余次氯酸除去的反应的化学方程式为
您最近一年使用:0次



