名校
1 . I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________ ,提供孤电子对的成键原子是________ 。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________ 。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________ ;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82−+8H2O=2MnO4−+10SO42−+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________ 。
(5)已知H2S2O8的结构如图:

①H2S2O8硫原子的轨道杂化方式为________________ 。
②上述反应每生成2 mol MnO4−,S2O82−断裂的共价键数目为_________ 。
③上述反应中被还原的元素为________________ 。
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82−+8H2O=2MnO4−+10SO42−+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:
(5)已知H2S2O8的结构如图:

①H2S2O8硫原子的轨道杂化方式为
②上述反应每生成2 mol MnO4−,S2O82−断裂的共价键数目为
③上述反应中被还原的元素为
您最近一年使用:0次
解题方法
2 . 氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________ ,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________ 。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________ 。
(3)N2F2分子中N原子的杂化方式是__________ ,l mol N2F2含有__________ molσ键.
(4)NF3的键角__________ NH3的键角(填“<”“>”或“=”),原因是__________ .
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________ mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________ .
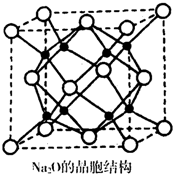
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为__________ ,Na2O晶体的密度为__________ g•cm-3(只要求列算式,不必计算出结果)。
(1)基态N原子中电子在2p轨道上的排布遵循的原则是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)N2F2分子中N原子的杂化方式是
(4)NF3的键角
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4
(6)安全气囊的设计原理为6NaN3+FeIO3
 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为

您最近一年使用:0次
3 . 硒化铜纳米晶体在光电转化中有着广泛的应用,铜和硒等元素形成的化合物在生产、生活中应用广泛。
(1)基态硒原子的核外电子排布式为______ 。As、Se、Br三种元素第一电离能由大到小的顺序为______ 。
(2)SeO2易溶解于水,熔点为340~350℃,315℃时升华,由此可判断SeO2中的化学键类型为______ 。
(3)Se2Cl2为深棕红色的剧毒液体,其分子结构中含有Se-Se 键,该分子中,Se原子的杂化轨道类型为______ ,Se2Cl2的空间构型为______ (填字母)。
a.直线形 b.锯齿形 c.环形 d.四面体形
(4)硒酸钢(CuSeO4)在电子、仪表工业中发挥着重要作用。硒酸的酸性与硫酸的比较,酸性较强的是______ (填化学式)。
(5)SeO42-中Se-O的键角比SeO3的键角______ (填“大“或“小“),原因是______ 。
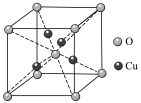
(6)铜的某种氧化物的晶胞结构如图所示,则该氧化物的化学式为______ ,若组成粒子氧、铜的半径分别为r(O)pm、r(Cu)pm,密度为ρg•cm-3,阿伏加 德罗常数的值为NA,则该晶胞的空间利用率为______ (用含π的式子表示)。

(1)基态硒原子的核外电子排布式为
(2)SeO2易溶解于水,熔点为340~350℃,315℃时升华,由此可判断SeO2中的化学键类型为
(3)Se2Cl2为深棕红色的剧毒液体,其分子结构中含有Se-Se 键,该分子中,Se原子的杂化轨道类型为
a.直线形 b.锯齿形 c.环形 d.四面体形
(4)硒酸钢(CuSeO4)在电子、仪表工业中发挥着重要作用。硒酸的酸性与硫酸的比较,酸性较强的是
(5)SeO42-中Se-O的键角比SeO3的键角
(6)铜的某种氧化物的晶胞结构如图所示,则该氧化物的化学式为
您最近一年使用:0次
2020-03-01更新
|
259次组卷
|
2卷引用:云南省楚雄彝族自治州2020届高三上学期期末考试理综化学试题
名校
解题方法
4 . 下列对分子性质的解释中,不正确的是( )
| A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| B.NF3和BF3的杂化方式不同,前者是sp2后者是sp3 |
| C.HCHO、CH3—、SO3的分子空间构型相同 |
D.由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子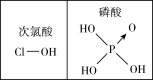 |
您最近一年使用:0次
解题方法
5 . 叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显___ 价,配位数是___ 。
(5)根据价层电子对互斥理论判断N3-的空间构型为___ 。与N3-互为等电子体的分子有___ (写一种即可)。
(1)下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显
(5)根据价层电子对互斥理论判断N3-的空间构型为
您最近一年使用:0次
6 . M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______ ,晶体中原子间通过_____ 作用形成面心立方密堆积,其中M原子的配位数为______ 。
(2)元素Y基态原子的核外电子排布式为________ ,其同周期元素中,第一电离能最大的是______ (写元素符号)。元素Y的含氧酸中,酸性最强的是________ (写化学式),该酸根离子的立体构型为________ 。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
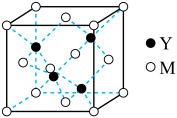
①该化合物的化学式为_______ ,已知晶胞参数a=0.542 nm,此晶体的密度为_______ g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________ 。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______ 。
(1)单质M的晶体类型为
(2)元素Y基态原子的核外电子排布式为
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②该化合物难溶于水但易溶于氨水,其原因是
您最近一年使用:0次
2016-12-09更新
|
1230次组卷
|
8卷引用:2016年全国普通高等学校招生统一考试化学(海南卷精编版)



