2018高三上·全国·专题练习
名校
解题方法
1 . 对于短周期元素形成的各分子,下表所述的对应关系错误的是
| 选项 | A | B | C | D |
| 分子式 | CH4 | NH3 | CO2 | SCl2 |
| VSEPR模型 | 正四面体形 | 四面体形 | 直线形 | 四面体形 |
| 分子的立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-03更新
|
542次组卷
|
6卷引用:2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式
(已下线)2018年11月28日《每日一题》一轮复习- 分子(或离子)构型与中心原子的杂化方式(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)广东省深圳市福田区外国语高级中学2022-2023学年高三上学期第二次调研考试化学试题广东省广州市海珠外国语实验中学2022-2023学年高三上学期第三次阶段性(期中)考试化学试题
名校
2 . 随着科学的发展,氟及其化合物的用途日益广泛。
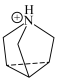
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。 是制备此离子液体的原料。
是制备此离子液体的原料。
(1)微粒中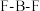 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
Ⅱ.氟化镁钾( )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的F。
(4) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为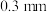 、面积为
、面积为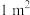 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
(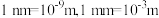 ,阿伏加德罗常数约为
,阿伏加德罗常数约为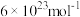 )。
)。
(5)我国科研工作者以 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
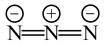
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
的结构简式如下: 中N原子的杂化方式为
中N原子的杂化方式为___________ , 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
② 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着___________ ,上述相互作用不会随 的转动改变。
的转动改变。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。
 是制备此离子液体的原料。
是制备此离子液体的原料。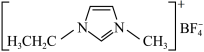
(1)微粒中
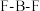 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 可以与
可以与 反应生成
反应生成 的原因是
的原因是Ⅱ.氟化镁钾(
 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。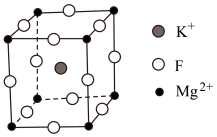
 晶体中,每个
晶体中,每个 周围有
周围有(4)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为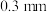 、面积为
、面积为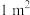 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
(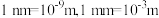 ,阿伏加德罗常数约为
,阿伏加德罗常数约为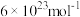 )。
)。(5)我国科研工作者以
 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
的结构简式如下: :
:
 :
:
 中N原子的杂化方式为
中N原子的杂化方式为 中心N原子的杂化方式为
中心N原子的杂化方式为②
 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着 的转动改变。
的转动改变。
您最近一年使用:0次
解题方法
3 . 钙是一种重要的化学元素,钙在地壳中含量较高且在多方面有着广泛的用途。回答下列问题:
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、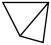 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是___________ ,石膏中层与层之间的作用力主要是___________ 。

(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA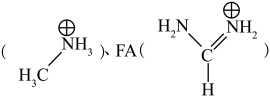 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是___________ ,1molFA中存在___________ 个 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。
(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为___________ ,同周期元素中与其最外层电子数相同的元素为___________ (填元素符号)。
②图a晶胞中O的位置为___________ (填“体心”“顶点”“面心”“棱心”,下同);图b晶胞中O的位置为___________ 。图a的晶胞参数为393.9pm,则O与O的最小核间距为___________ pm(写出表达式)。
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、
 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是
(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA
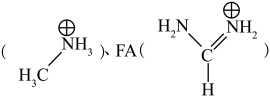 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为
②图a晶胞中O的位置为
您最近一年使用:0次
解题方法
4 . 磷、硼及其化合物用途非常广泛。回答下列问题:
(1)镍的一种配合物为 ,Ph表示苯基。
,Ph表示苯基。
①基态Ni原子价电子排布式为___________ ;镍在周期表中位于第___________ 周期第___________ 族。
②配体为___________ ; 分子中含σ键数为
分子中含σ键数为___________ 个。
(2) 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应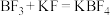 制备。
制备。
① 中阴离子空间构型为
中阴离子空间构型为___________ ,该物质中含有的化学键类型有___________ (填字母)
A.离子键 B.共价键 C.配位键 D.氢键
② 分子的B-F键间的键角比
分子的B-F键间的键角比 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是___________ 。
(3)磷化硼是一种半导体材料,密度为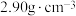 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于___________ 晶体;其晶胞参数a=___________ nm(列出计算式)。

(1)镍的一种配合物为
 ,Ph表示苯基。
,Ph表示苯基。①基态Ni原子价电子排布式为
②配体为
 分子中含σ键数为
分子中含σ键数为(2)
 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应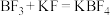 制备。
制备。①
 中阴离子空间构型为
中阴离子空间构型为A.离子键 B.共价键 C.配位键 D.氢键
②
 分子的B-F键间的键角比
分子的B-F键间的键角比 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是(3)磷化硼是一种半导体材料,密度为
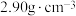 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
您最近一年使用:0次
解题方法
5 . 硼、钾和硒( )在化工行业中有重要用途,请回答下列问题。
)在化工行业中有重要用途,请回答下列问题。
(1)X是一种抗癌新药,其结构如下:_______ 。
②关于化合物X,下列说法正确的是_______ 。
A.碳、硒元素的杂化方式均为
B.元素电负性大小
C.能量最低的激发态 原子的电子排布式:
原子的电子排布式:
D.该新药中有8种不同化学环境的碳
(2)氨硼烷( )具有良好的储氢能力,分子中有配位键。则氨硼烷中
)具有良好的储氢能力,分子中有配位键。则氨硼烷中 的键角
的键角___________ (填“>”“<”或“=”)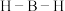 的键角,理由是
的键角,理由是___________ 。
(3)某化合物晶体晶胞结构如图所示,该立方晶胞边长为 。该晶体中与
。该晶体中与 最近且距离相等的
最近且距离相等的 有
有___________ 个,晶体的密度为_______  (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
 )在化工行业中有重要用途,请回答下列问题。
)在化工行业中有重要用途,请回答下列问题。(1)X是一种抗癌新药,其结构如下:
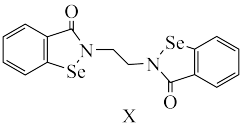
②关于化合物X,下列说法正确的是
A.碳、硒元素的杂化方式均为

B.元素电负性大小

C.能量最低的激发态
 原子的电子排布式:
原子的电子排布式:
D.该新药中有8种不同化学环境的碳
(2)氨硼烷(
 )具有良好的储氢能力,分子中有配位键。则氨硼烷中
)具有良好的储氢能力,分子中有配位键。则氨硼烷中 的键角
的键角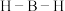 的键角,理由是
的键角,理由是(3)某化合物晶体晶胞结构如图所示,该立方晶胞边长为
 。该晶体中与
。该晶体中与 最近且距离相等的
最近且距离相等的 有
有 (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。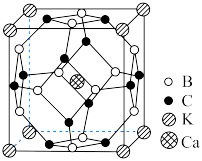
您最近一年使用:0次
名校
解题方法
6 . 三卤化氮( )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:
(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式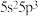 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是___________ 。基态锑原子中有___________ 个未成对电子,这些未成对电子具有___________ (填“相同”或“不同”)的自旋状态。
(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是___________ ,原子半径由大到小的顺序是___________ 。
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为___________ 。液晶在放电过程中会产生 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是___________ ,键角:
___________  (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。
(4)已知热稳定性 高于
高于 ,解释其原因是
,解释其原因是___________ 。常温常压下 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为___________ , 和
和 的分子空间构型均为
的分子空间构型均为___________ 。
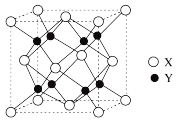
(5) 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是___________ ;若该立方晶胞参数为apm, 的摩尔质量用
的摩尔质量用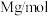 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度=___________  (写出表达式)。
(写出表达式)。
 )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式
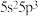 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为
 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是
 (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。(4)已知热稳定性
 高于
高于 ,解释其原因是
,解释其原因是 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为 和
和 的分子空间构型均为
的分子空间构型均为(5)
 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是 的摩尔质量用
的摩尔质量用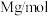 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度= (写出表达式)。
(写出表达式)。
您最近一年使用:0次
2023-05-14更新
|
93次组卷
|
3卷引用:河北省石家庄市河北师范大学附属实验中学2024届高三上学期10月月考化学试题
名校
解题方法
7 . 水合硫酸四氨合铜[Cu(NH3)4(H2O)2]SO4在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述正确的是
A.[Cu(NH3)4(H2O)2]SO4中 的空间构型为平面三角型 的空间构型为平面三角型 |
| B.[Cu(NH3)4(H2O)2]2+中存在离子键、配位键和极性共价键 |
| C.NH3分子中H-N-H键的角小于H2O分子中H-O-H键的健角 |
| D.NH3和H2O与Cu2+的配位能力:NH3>H2O |
您最近一年使用:0次
名校
解题方法
8 . 物质的光学性质在科研中有重要的用途。回答下列问题:
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:___________ ,M中键角F-B-F___________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为___________ 。
(2)均为平面结构的吡咯(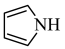 )和吡啶(
)和吡啶(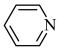 )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为___________ ,原因是___________ 。
Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。 的配位数为
的配位数为___________ ,阴离子形成的八面体空隙有___________ 个。
(4)该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为___________ nm。
Ⅰ.一种比率光声探针M与Cu2+配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
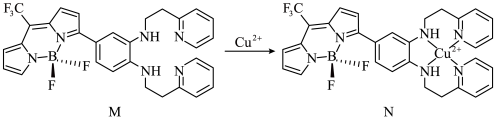
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.铪(Hf)的卤化物八面体离子是构建卤化物钙钛矿的基本发光单元,其构建的某晶胞结构如图所示。
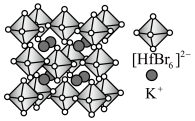
 的配位数为
的配位数为(4)该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Hf-Hf最近距离为
,则Hf-Hf最近距离为
您最近一年使用:0次
2024-03-14更新
|
1092次组卷
|
4卷引用:山东省烟台市2024届高三一模化学试题
山东省烟台市2024届高三一模化学试题2024届山东省高三下学期第一次练兵考试一模化学试题山东省德州市2023-2024学年高三下学期一模考试化学试题(已下线)化学(山东卷03)-2024年高考押题预测卷
名校
解题方法
9 . 由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
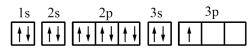
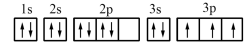
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
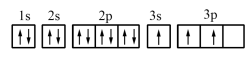
 .
.
 .
.
 .
.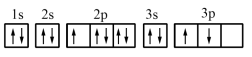
其中能量最低的是_______ (填字母)。
(2)C、O、N 原子的第一电离能由大到小的顺序为_______ ;H2S的键角比H2O的键角_______ (填“大”或“小”)
(3)铁能与三氮唑(结构见图甲)形成多种配合物。
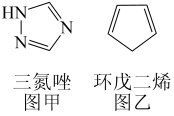
①l mol三氮唑中所含σ键的数目为_______ mol; 碳原子杂化方式是_______ ;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
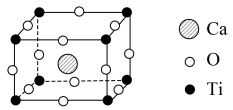
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是_______ cm(已知晶胞参数为anm)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
 .
.
其中能量最低的是
(2)C、O、N 原子的第一电离能由大到小的顺序为
(3)铁能与三氮唑(结构见图甲)形成多种配合物。

①l mol三氮唑中所含σ键的数目为
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近一年使用:0次
2023-08-27更新
|
71次组卷
|
2卷引用:陕西省汉中中学2024届高三上学期8月质量检测化学试题
解题方法
10 . 氧族元素包括氧、硫、硒等,这些元素的单质及其化合物在工农业生产和科学研究中具有广泛的用途。回答下列问题:
(1)下列属于氧原子激发态的轨道表示式的有___________ (填字母,下同),其中失去最外层上一个电子所需能量最低的是___________ 。
a. b.
b.
c.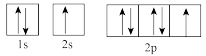 d.
d.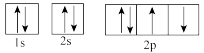
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
① 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的___________ 杂化轨道形成S—S___________ (填“ ”或“
”或“ ”)共价键。
”)共价键。
② 分子结构中H—O—O键角为
分子结构中H—O—O键角为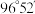 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角___________ (填“=”“>”或“<”)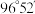 。
。
③ 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是___________ 。
(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:
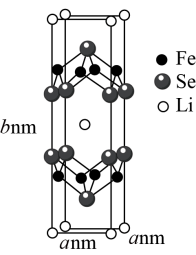
1个晶胞中的Se原子数为___________ 。晶胞的部分参数如图所示,且晶胞棱边夹角均为90°,晶体密度为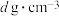 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (列式表示)。
(1)下列属于氧原子激发态的轨道表示式的有
a.
 b.
b.
c.
 d.
d.
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
| 物质 | 熔点/℃ | 沸点/℃ |  制备方法 制备方法 |
 | -90.0 | 71.0 | 加热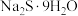 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 |
 | -0.4 | 150.0 |
 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的 ”或“
”或“ ”)共价键。
”)共价键。②
 分子结构中H—O—O键角为
分子结构中H—O—O键角为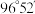 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角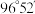 。
。③
 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:

1个晶胞中的Se原子数为
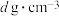 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次



