名校
解题方法
1 . 磷的单质和化合物在科研与生产中有许多重要用途。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____ 对成键电子对和____ 对孤电子对。
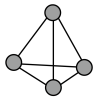
(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为_______ 。但NCl5不存在,其原因是________________________ ;
(3)电负性比较:P_____ S(填“>”“=”“<”);而P的第一电离能比S大的原因是______ 。
(4)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。
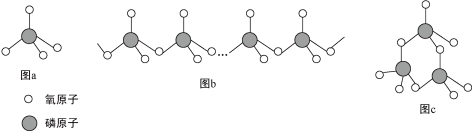
直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:_______ ;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为________ 。
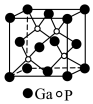
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
①与Ga紧邻的P个数为________ 。
②GaP晶体的密度为(列出计算式)______ g·cm-3(NA为阿伏加德罗常数)。
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为
(3)电负性比较:P
(4)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。

直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
①与Ga紧邻的P个数为
②GaP晶体的密度为(列出计算式)

您最近一年使用:0次
名校
解题方法
2 . 锰、砷、镓及其相关化合物用途非常广泛。
(1)Mn2+基态核外电子排布式为__________ 。
(2)砷与镓、硒是同周期的主族元素,其第一电离能从小到大的顺序是__________ 。
(3)BrCH2CN可用于制备砷叶立德,BrCH2CN 分子中碳原子杂化轨道类型是__________ 。
(4)在AlCl3存在下,将C2H2通入AsCl3可得到(ClCH=CH)2AsCl等物质,AsCl3分子的几何构型为__________ ,1mol(ClCH=CH)2AsCl分子中含σ键的数目为__________ 。
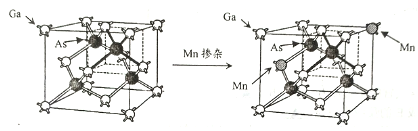
(5)GaAs是一种重要的半导体材料,按图示掺杂锰后可得稀磁性半导体材料(晶体结构不变),则该材料晶体中n(Ga) ∶n(Mn) ∶n(As)=__________ 。
(1)Mn2+基态核外电子排布式为
(2)砷与镓、硒是同周期的主族元素,其第一电离能从小到大的顺序是
(3)BrCH2CN可用于制备砷叶立德,BrCH2CN 分子中碳原子杂化轨道类型是
(4)在AlCl3存在下,将C2H2通入AsCl3可得到(ClCH=CH)2AsCl等物质,AsCl3分子的几何构型为
(5)GaAs是一种重要的半导体材料,按图示掺杂锰后可得稀磁性半导体材料(晶体结构不变),则该材料晶体中n(Ga) ∶n(Mn) ∶n(As)=

您最近一年使用:0次
2018-05-17更新
|
302次组卷
|
2卷引用:【全国市级联考】江苏省盐城市2018届高三第三次模拟考试化学试题
3 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
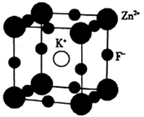
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近一年使用:0次
2018-01-07更新
|
409次组卷
|
6卷引用:甘肃省张掖市2018届高三第一次质量检测考试理综化学试题
名校
4 . 氮(N)、磷(P)、砷(As)等都是VA族元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)As原子的价电子排布式为____________ 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是________________ 。
(3)NH4+中H—N—H的键角比NH3分子中的键角________ (填“大”或“小”),原因是____________ 。
(4)NaAsO4中含有的化学键类型包括__________ ;AsO43-的空间构型为_____________ ;As4O6的分子结构如下图所示,则在该化合物中As原子的杂化方式是____________ 。
(5)2017年1月27日,我国科学家在《Science》杂质上发表论文,在全氮阴离子盐合成上取得重大进展,首次制得试问下稳定,含有N5-离子的盐(具有超高能量密度的化合物),N5-离子中氮元素的平均化合价为_____ 。
(6)白磷(P)的晶体属于分子晶体,其晶胞结构如下图(小圆圈表示白磷分子)。该晶胞中含有的P原子数为_______ ;已知该晶胞的边长为a cm,阿伏伽德罗常数为NAmol-1,则该晶体的密度为_____ g·cm-3(用含有NA的式子表示)
(1)As原子的价电子排布式为
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是
(3)NH4+中H—N—H的键角比NH3分子中的键角
(4)NaAsO4中含有的化学键类型包括

(5)2017年1月27日,我国科学家在《Science》杂质上发表论文,在全氮阴离子盐合成上取得重大进展,首次制得试问下稳定,含有N5-离子的盐(具有超高能量密度的化合物),N5-离子中氮元素的平均化合价为
(6)白磷(P)的晶体属于分子晶体,其晶胞结构如下图(小圆圈表示白磷分子)。该晶胞中含有的P原子数为

您最近一年使用:0次
解题方法
5 . 由金属Na、Cu、C、N、B等元素组成的物质在生活和工业上有着广泛用途。
(1)基态Cu+的外围电子轨道式为_______ 。
(2)H3BNH3是储氢材料,其制备原理为:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,其中(HB=NH)3是一种六元环状化合物。化合物H3BNH3中B原子的杂化方式为_______ ;1个(HB=NH)3分子中含有 ___ 个σ键。
(3) B、C、N、O原子的第一电离能由大到小的顺序为_____________________ 。
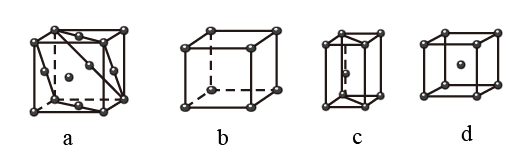
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为____ (填字母)。
(5)已知NaCl的摩尔质量为Mg·mol-1,密度为pg·㎝-3,阿伏伽德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为____________ 。
(1)基态Cu+的外围电子轨道式为
(2)H3BNH3是储氢材料,其制备原理为:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,其中(HB=NH)3是一种六元环状化合物。化合物H3BNH3中B原子的杂化方式为
(3) B、C、N、O原子的第一电离能由大到小的顺序为
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为

(5)已知NaCl的摩尔质量为Mg·mol-1,密度为pg·㎝-3,阿伏伽德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为
您最近一年使用:0次
名校
6 . 铁元素和碳元素形成的单质及化合物在生产、生活中有广泛的用途,
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为_________________ ;其最外层电子的电子云形状为___________ 。
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为____________________ 。
写出一种与NH4+互为等电子体的分子的电子式:________________________________ 。
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为______________ 。CO的沸点高于N2的原因是_________________________ 。
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为______________________ 。
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为________________ ;1cm3晶体的平均质量为___________ (列出计算式即可)。
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为
(2)(NH4)2Fe(SO4)2 • 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为
写出一种与NH4+互为等电子体的分子的电子式:
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏伽德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次
名校
7 . 自然界中不存在氟的单质,得到单质氟共经历了一百多年时间,不少科学家为此献出了宝贵的生命,在1886年法国的化学家Moissa终于发明了摩式电炉,用电解法成功的制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途,请回答下列问题:
(1)氟磷灰石可用于制取磷肥,其中Ca原子的L层电子排布式为___________ 。P原子有___________ 个未成对电子,PO43-的中心P原子的杂化方式为___________ 。
(2)氟气可以用于制取火箭燃料的氧化剂ClF3和BrF3,其中沸点较高的是_____________ (填化学式),原因是_____________ 。
(3)氟气可以用于制取惰性强于N2的保护气SF6;可以用于制取聚合反应的催化剂PF3,可以作为工业制取硅单质的中间(SiCl4)的原料。
①SiCl4分子的空间构型为_________________ 。
②S、P、Si的第一电离由大到小的顺序为__________________ 。
(4)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯,50g四氟乙烯含σ键的数目为________________ 。
(5)工业上电解Al2O3制取单质铝,常利用冰晶石NaAlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为______________ ,工业上不用电解AlCl3制取铝的原因为________________ 。
(6)已知CaF2晶体常用于助熔剂,其晶胞结构如图所示。
已知F原子和Ca原子之间的距离为apm,在晶胞体对角线的1/4、3/4两点分别有一个F-,阿伏伽德罗常数为NA,则晶体的密度为_____________ 。
(1)氟磷灰石可用于制取磷肥,其中Ca原子的L层电子排布式为
(2)氟气可以用于制取火箭燃料的氧化剂ClF3和BrF3,其中沸点较高的是
(3)氟气可以用于制取惰性强于N2的保护气SF6;可以用于制取聚合反应的催化剂PF3,可以作为工业制取硅单质的中间(SiCl4)的原料。
①SiCl4分子的空间构型为
②S、P、Si的第一电离由大到小的顺序为
(4)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯,50g四氟乙烯含σ键的数目为
(5)工业上电解Al2O3制取单质铝,常利用冰晶石NaAlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为
(6)已知CaF2晶体常用于助熔剂,其晶胞结构如图所示。

已知F原子和Ca原子之间的距离为apm,在晶胞体对角线的1/4、3/4两点分别有一个F-,阿伏伽德罗常数为NA,则晶体的密度为
您最近一年使用:0次
名校
解题方法
8 . 前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸(本题中出现的 B 、 C 均为字母,不是元素符号 )。
(1)D元素基态原子的外围电子排布式为____________________ 。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________ (用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________ (用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是___ 。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式_____________________________ 。
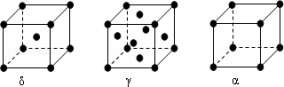
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如下图所示)中F原子的配位数之比为___________ ,δ、γ、α三种晶胞的边长之比为_____________ 。
(1)D元素基态原子的外围电子排布式为
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为
(3)B、X、D氢化物的沸点由高到低的顺序为
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
| 微粒 | CO32- | CO42- |
| 立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如下图所示)中F原子的配位数之比为

您最近一年使用:0次
2017-05-24更新
|
469次组卷
|
4卷引用:山西省山西大学附属中学2017届高三下学期3月模块诊断理科综合化学试题
解题方法
9 . 【物质结构与性质】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式____________ 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图
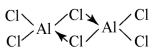
缔合双分子Al2Cl6中Al原子的轨道杂化类型是_______ 。
(3)B原子的电子有_____ 个不同的能级;晶体硼熔点为2300℃,则其为_____ 晶体。
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
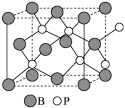
①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼___________________ 三溴化磷____________________
②在BP晶胞中B的堆积方式为__________________ 。
③计算当晶胞晶格参数为a pm(即图中立方体的每条边长为 a pm)时,磷化硼中硼原子和磷原子之间的最近距离____________ 。
(1)写出基态镓原子的电子排布式
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图

缔合双分子Al2Cl6中Al原子的轨道杂化类型是
(3)B原子的电子有
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
②在BP晶胞中B的堆积方式为
③计算当晶胞晶格参数为a pm(即图中立方体的每条边长为 a pm)时,磷化硼中硼原子和磷原子之间的最近距离
您最近一年使用:0次
2016-12-09更新
|
139次组卷
|
2卷引用:2016届陕西省西安市长安区十中高三下学期第三次月考化学试卷



