1 . 合成氨对人类生存具有重大意义,反应为: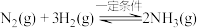
(1) 的空间结构是
的空间结构是_______ 。
(2)传统合成氨工艺是将 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入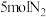 、
、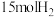 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
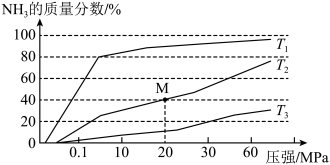
①温度 、
、 、
、 大小关系是
大小关系是_______ 。
②M点的平衡常数K=_______ (可用分数表示)。
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入 ,b处通入
,b处通入 。
。
①该装置中的能量转化形式是:_______ 能转化为_______ 能。
②导线中电子移动方向是_______ (填“a→b”或“b→a”)。
③相比传统工业合成氨,该方法的优点有_______ (任写一点)。
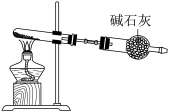
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
已知: 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
(5)温度为 时,将
时,将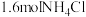 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:
①4~7min,HCl的平均反应速率为_______ 。
②其它条件不变,9min后,向容器中加入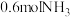 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,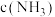
_______ (填“增大”、“减小”或“不变”)。
③下列描述中,可以表明该反应达到化学平衡状态的是_______ 。
A.容器中固体质量不变
B.容器中 的含量不变
的含量不变
C.容器中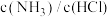 的比值不变
的比值不变
D.容器中气体压强不变
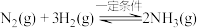
(1)
 的空间结构是
的空间结构是(2)传统合成氨工艺是将
 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入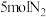 、
、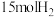 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
①温度
 、
、 、
、 大小关系是
大小关系是②M点的平衡常数K=
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入
 ,b处通入
,b处通入 。
。①该装置中的能量转化形式是:
②导线中电子移动方向是
③相比传统工业合成氨,该方法的优点有
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
已知:
 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
A. | B. | C. | D. |
 时,将
时,将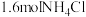 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:| t/min | 2 | 4 | 7 | 9 |
 | 0.4 | 0.5 | 0.6 | 0.6 |
②其它条件不变,9min后,向容器中加入
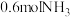 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,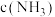
③下列描述中,可以表明该反应达到化学平衡状态的是
A.容器中固体质量不变
B.容器中
 的含量不变
的含量不变C.容器中
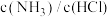 的比值不变
的比值不变 D.容器中气体压强不变
您最近半年使用:0次
2 . 化合物M由原子序数依次增大的前20号元素X、Y、Z组成,其中X、Y为同周期相邻元素。M是一种固体氮肥,又名石灰氮,属于离子化合物,阴、阳离子个数比为1:1。Z是构成动物骨骼和牙齿的重要元素,M中Z元素的质量分数为50%。下列说法正确的是
| A.简单氢化物的沸点:X>Y |
| B.X、Y所在周期的非金属元素有6种 |
| C.Z元素的最高价氧化物对应的水化物是一种弱碱 |
| D.M的阴离子中各原子均满足8电子稳定结构 |
您最近半年使用:0次
名校
解题方法
3 . 锰酸锂(LiMn2O4) 可作为某锂离子电池的正极材料,工业上利用软锰矿浆(主要成分为 MnO2,含少量 Fe2O3、FeO、Al2O3、SiO2。等杂质)吸收含硫烟气(主要成分 SO2) 制备锰酸锂,生产流程如图所示:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
(1)含硫烟气中 SO2的VSEPR模型为___________ 。
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是___________ 。
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:___________ 。
(4)滤液1中所含金属阳离子除 以外还有
以外还有___________ (填离子符号)。
(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入___________ ,再加入NaOH溶液调节pH范围为___________ ,过滤得到滤液 2 和滤渣,请设计实验方案由滤渣制得纯净 Al(OH)3[Al(OH)3在 pH≥12时溶解]的实验方案:___________ 。
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:___________ 。
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:
 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为___________ 。

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气中 SO2的VSEPR模型为
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:
(4)滤液1中所含金属阳离子除
 以外还有
以外还有(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:

 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为
您最近半年使用:0次
解题方法
4 . 化合物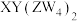 可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数和p能级上的电子总数相等,W和Z同族,Y是地壳中含量最多的金属元素,下列说法正确的是
可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数和p能级上的电子总数相等,W和Z同族,Y是地壳中含量最多的金属元素,下列说法正确的是
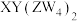 可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数和p能级上的电子总数相等,W和Z同族,Y是地壳中含量最多的金属元素,下列说法正确的是
可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数和p能级上的电子总数相等,W和Z同族,Y是地壳中含量最多的金属元素,下列说法正确的是| A.第一电离能:X>Y>Z | B.简单氢化物沸点:Z>W |
| C.原子半径:Z>Y>X>W | D.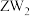 和 和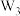 的空间结构均为V形 的空间结构均为V形 |
您最近半年使用:0次
名校
解题方法
5 . X、Y、Z、W为原子序数依次增大的前四周期元素,X为元素周期表中半径最小的原子,Z是地壳中含量最多的元素,W的原子序数为29,X、Y、Z、W形成的阳离子如图所示,下列说法正确的是
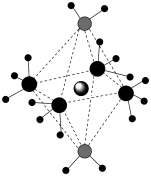
A.原子半径: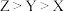 | B.该阳离子中心离子的配位数为6 |
C.氢化物的沸点: | D.两种配体中的键角: |
您最近半年使用:0次
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的价电子排布式可表示为nsnnpn+1,Y是地壳中含量最多的元素,Z的原子半径在短周期中最大,Y、W同主族。下列说法正确的是
| A.简单离子半径:Z<Y<W | B.简单气态氢化物的稳定性:X<Y<W |
| C.元素的第一电离能:X<Y | D.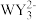 的VSEPR模型为平面三角形 的VSEPR模型为平面三角形 |
您最近半年使用:0次
解题方法
7 . 钙是一种重要的化学元素,钙在地壳中含量较高且在多方面有着广泛的用途。回答下列问题:
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、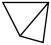 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是___________ ,石膏中层与层之间的作用力主要是___________ 。

(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA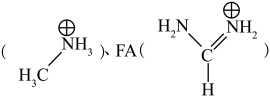 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是___________ ,1molFA中存在___________ 个 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。
(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为___________ ,同周期元素中与其最外层电子数相同的元素为___________ (填元素符号)。
②图a晶胞中O的位置为___________ (填“体心”“顶点”“面心”“棱心”,下同);图b晶胞中O的位置为___________ 。图a的晶胞参数为393.9pm,则O与O的最小核间距为___________ pm(写出表达式)。
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、
 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是
(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA
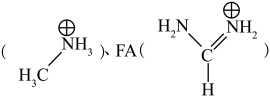 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为
②图a晶胞中O的位置为
您最近半年使用:0次
23-24高二上·广东深圳·期末
名校
8 . 化合物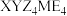 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为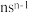 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是
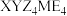 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为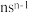 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是A.元素电负性: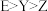 | B.简单氢化物沸点: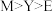 |
C.第一电离能: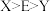 | D.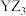 和 和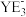 空间结构均为三角锥形 空间结构均为三角锥形 |
您最近半年使用:0次
解题方法
9 . 已知X、Y、Z、W、R是元素周期表前四周期中原子序数依次增大的常见元素,相关信息如下表:
(1)X基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(2) 是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为
是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为___________ 。
(3)Z的基态原子的电子排布式为___________ 。
(4)H2Y的中心原子采取___________ 杂化,VSEPR模型为___________ ,分子构型为___________ 。
| 元素 | 相关信息 |
| X | 元素原子的核外p电子数比s电子数少1 |
| Y | 地壳中含量最多的元素 |
| Z | 第一电离能至第四电离能分别是: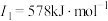 , , , ,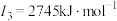 , ,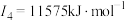 |
| W | 前四周期中电负性最小的元素 |
| R | 在周期表的第十一列 |
(2)
 是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为
是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为(3)Z的基态原子的电子排布式为
(4)H2Y的中心原子采取
您最近半年使用:0次
名校
解题方法
10 . 化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是
| A.元素电负性:E>Y>Z | B.1mol M中含有共价键数目为4NA |
| C.半径:X2+>E2- | D.YZ3和YE 的空间结构均为三角锥形 的空间结构均为三角锥形 |
您最近半年使用:0次



