解题方法
1 . 2021年5月15日“天问一号”着陆火星,我国拟于2028年实施火星取样返回任务。火星土壤中含有原子序数依次增大的短周期主族元素W、X、Y、Z。W为地壳中含量最多的元素,且W、Z位于同一族。X、Y、Z为同周期互不相邻的元素,Z的最外层电子数是X和Y的最外层电子数之和。下列说法正确的是
A.熔点: |
| B.最简单氢化物的稳定性:W>Z>Y |
C.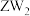 和 和 分子的VSEPR模型不同 分子的VSEPR模型不同 |
| D.工业上通常利用电解熔融XW的方法来制备X的单质 |
您最近一年使用:0次
20-21高二·全国·课时练习
2 . 元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)确定X、Y两种元素在周期表中的位置分别为________________ 、________________ 。
(2)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式_______ ;该分子的中心原子以_______ 杂化,分子构型为_______ 。
(3)写出X的质量分数为60%的化合物的化学式________________ ;该分子的中心原子以________ 杂化,分子构型为________ 。
(4)由氢元素与X元素形成的化合物中,含有非极性键的是________ (写分子式),分子构型为V形的是________ (写分子式)。
(1)确定X、Y两种元素在周期表中的位置分别为
(2)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式
(3)写出X的质量分数为60%的化合物的化学式
(4)由氢元素与X元素形成的化合物中,含有非极性键的是
您最近一年使用:0次
3 .  是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点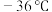 ,沸点
,沸点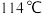 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
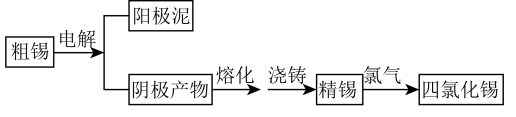
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸 和硅氟酸亚锡
和硅氟酸亚锡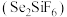 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为___________ 。阴极的电极反应式为___________ ,根据价层电子对互斥理论和杂化轨道理论,判断 离子的空间构型是
离子的空间构型是___________ ,硅的杂化类型是___________ 。
(2)某同学模拟工业制法设计了由 与
与 反应制取
反应制取 的实验装置:
的实验装置:
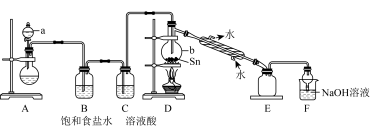
①a中浓盐酸与烧瓶内固体反应生成 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用___________ ,仪器b的名称为___________ 。
②装置D的主要缺点是___________ ,除此之外,整套装置还有的缺点是___________ 。
③制取 中可能会产生少量
中可能会产生少量 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液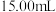 ,则产品中
,则产品中 的含量为
的含量为___________  (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是___________ (用离子方程式表示)。
 是一种重要的工业原料,常用作媒染剂等。已知
是一种重要的工业原料,常用作媒染剂等。已知 常温下是无色液体,在潮湿空气中易水解,熔点
常温下是无色液体,在潮湿空气中易水解,熔点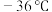 ,沸点
,沸点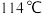 。工业上制备
。工业上制备 的工艺流程如图:
的工艺流程如图:
请回答下列问题;
(1)粗锡电解精炼时,常用硅氟酸
 和硅氟酸亚锡
和硅氟酸亚锡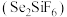 为电解液。已知
为电解液。已知 为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为
为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为 离子的空间构型是
离子的空间构型是(2)某同学模拟工业制法设计了由
 与
与 反应制取
反应制取 的实验装置:
的实验装置:
①a中浓盐酸与烧瓶内固体反应生成
 ,则烧瓶内固体可以选用
,则烧瓶内固体可以选用②装置D的主要缺点是
③制取
 中可能会产生少量
中可能会产生少量 ,为测定产品中
,为测定产品中 的含量,可选用重铬酸钾标准液滴定,准确称取该样品
的含量,可选用重铬酸钾标准液滴定,准确称取该样品 放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成
放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成 溶液,取
溶液,取 于锥形瓶中,用
于锥形瓶中,用 重铬酸钾标准溶液滴定至终点,消耗标准液
重铬酸钾标准溶液滴定至终点,消耗标准液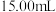 ,则产品中
,则产品中 的含量为
的含量为 (用含m的代数式表示),测定
(用含m的代数式表示),测定 含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
含量会随在烧杯中配制时间的增加而逐渐增大,其原因可能是
您最近一年使用:0次
名校
解题方法
4 . 我国硒含量居世界首位,含硒化合物与材料被广泛应用于合成化学、催化化学医学研究、环境保护、农业化学品等方面。
(1)硒原子核外电子排布式为_______
(2)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,甲硒醇分子中碳原子和硒原子的杂化类型分别是_______ 、_______ 。下表中有机物沸点不同的原因是_______ 。
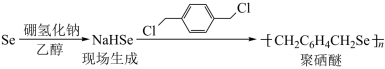
(3)NaHSe可用于合成聚硒醚,NaHSe晶体类型为_______ ,得到NaHSe过程中生成的化学键类型为_______ 。聚硒醚能清除水中的铅污染,其原因是_______ 。
(4)硒酸是一种强酸,根据价层电子对互斥理论的推测,其阴离子空间构型是_______
(5)Na2Se的晶体结构如下图所示,其晶胞参数为anm,阿伏加德罗常数值为NA.则Na2Se的晶胞密度为_______ g·cm-3(列出计算式)。

(1)硒原子核外电子排布式为
(2)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,甲硒醇分子中碳原子和硒原子的杂化类型分别是
| 有机物 | 甲醇 | 甲硫醇 | 甲硒醇 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |

(4)硒酸是一种强酸,根据价层电子对互斥理论的推测,其阴离子空间构型是
(5)Na2Se的晶体结构如下图所示,其晶胞参数为anm,阿伏加德罗常数值为NA.则Na2Se的晶胞密度为

您最近一年使用:0次
2022-02-17更新
|
383次组卷
|
2卷引用:江西省九江市2022届高三第一次高考模拟统一考试理综化学试题
名校
解题方法
5 . 我国科学家最近揭示了叶片中C、N、P的化学含量以及环境调控。下列说法正确的是
A.基态原子的末成对电子数: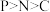 | B.电负性: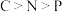 |
C.键角: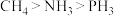 | D.第一电离能: |
您最近一年使用:0次
2022-05-31更新
|
256次组卷
|
2卷引用:海南省海口市2022届高三学生学科能力诊断(二)化学试题
名校
解题方法
6 . 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为_______ ,其电子占据最高能级的电子云轮廓图为_______ 形。
(2)根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是_______ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_______ 形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
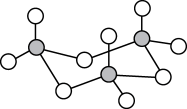
(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:_______ 。
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸: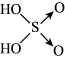 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。
①请写出亚磷酸的结构式_______ 。
② 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
| H2S | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸:
 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。①请写出亚磷酸的结构式
②
 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
解题方法
7 . X、Y、Z、Q、R五种短周期主族元素,原子序数依次增大。X、Q元素的原子最外层电子数均为其原子核外电子层数的2倍;X、Y元素原子序数之和等于Z元素原子核外电子数,Z元素为地壳中含量最高的金属元素。下列说法正确的是
| A.X、Y、Q、R元素均能与氢元素形成原子个数比为1:2的分子 |
| B.Y、Z、Q、R形成的简单离子半径大小顺序为r(Z)>r(Y),r(Q)>r(R) |
| C.Q、X、R元素的氧化物对应水化物的酸性可能依次减弱 |
| D.Y与R元组成的YR3分子,空间构型为平面正三角形 |
您最近一年使用:0次
8 . 我国硒含量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸(H2SeO3)进而制备单质硒。
(1)工业上在103℃的条件下,用甲酸(HCOOH)还原含亚硒酸(H2SeO3)的工业废液提取硒,此反应的化学方程式为___________ 。
(2)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液也可直接制得单质硒,写出电解时阴极上发生的电极反应___________ 。
(3)基态Se原子电子占据最高能级的电子云轮廓图为___________ 形。 号的空间结构为
号的空间结构为___________ 形。
(4)关于硒单质及其化合物说法正确的是___________ (填标号)。
a.硒单质在常温下呈固态 b. 既有氧化性又有还原性
既有氧化性又有还原性
c.键角: d.
d. 的最高价氧化物对应水化物的化学式为
的最高价氧化物对应水化物的化学式为
(5)室温下, 电离平衡体系中含
电离平衡体系中含 微粒的物质的量分数与溶液
微粒的物质的量分数与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:

 的
的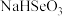 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为___________ ,计算反应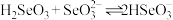 的平衡常数K=
的平衡常数K=___________ 。
(1)工业上在103℃的条件下,用甲酸(HCOOH)还原含亚硒酸(H2SeO3)的工业废液提取硒,此反应的化学方程式为
(2)研究表明,电解亚硒酸钠(Na2SeO3)、聚乙二醇和盐酸混合液也可直接制得单质硒,写出电解时阴极上发生的电极反应
(3)基态Se原子电子占据最高能级的电子云轮廓图为
 号的空间结构为
号的空间结构为(4)关于硒单质及其化合物说法正确的是
a.硒单质在常温下呈固态 b.
 既有氧化性又有还原性
既有氧化性又有还原性c.键角:
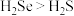 d.
d. 的最高价氧化物对应水化物的化学式为
的最高价氧化物对应水化物的化学式为
(5)室温下,
 电离平衡体系中含
电离平衡体系中含 微粒的物质的量分数与溶液
微粒的物质的量分数与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:
 的
的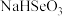 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为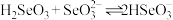 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
名校
9 . 我国硒含量居世界首位,含硒化合物与材料被广泛应用于合成化学、催化化学、医学研究、环境保护、农业化学品等方面。
(1)硒在周期表中的位置为___________ ,根据元素周期表分区属于___________ 区。
(2)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,甲硒醇分子中硒原子的杂化类型是______ ,下表中有机物沸点不同的原因是___________ 。
(3)NaHSe可用于合成聚硒醚: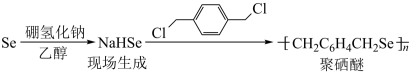 。NaHSe晶体类型为
。NaHSe晶体类型为___________ ,得到NaHSe过程中生成的化学键类型为___________ 。聚硒醚能清除水中的铅污染,其原因是___________ 。
(4)硒酸是一种强酸,根据价层电子对互斥理论的推测,其硒酸根离子的空间构型是_____ 。
(5)Na2Se的晶体结构如图所示,其晶胞参数为anm,阿伏加德罗常数值为NA,则Na2Se的晶胞密度为___________ g·cm-3(列出计算式)。

(1)硒在周期表中的位置为
(2)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,甲硒醇分子中硒原子的杂化类型是
| 有机物 | 甲醇 | 甲硫醇 | 甲硒醇 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |
 。NaHSe晶体类型为
。NaHSe晶体类型为(4)硒酸是一种强酸,根据价层电子对互斥理论的推测,其硒酸根离子的空间构型是
(5)Na2Se的晶体结构如图所示,其晶胞参数为anm,阿伏加德罗常数值为NA,则Na2Se的晶胞密度为

您最近一年使用:0次
名校
解题方法
10 . 短周期主族元素X、Y、Z、R的原子序数依次增大,X是地壳中含量最高的元素,Z在X中燃烧火焰呈黄色,R基态原子p能级有一对成对电子。下列说法正确的是
| A.原子半径:Z>R>X>Y |
| B.气态氢化物的稳定性:X>Y>R |
| C.X与Z组成的化合物肯定含有共价键 |
| D.X与R组成的化合物VSEPR模型一定和CH4的一样 |
您最近一年使用:0次
2022-01-18更新
|
249次组卷
|
2卷引用:北京市门头沟区2021-2022学年高三上学期期末调研化学试题



