1 . 合成氨对人类生存具有重大意义,反应为: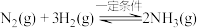
(1) 的空间结构是
的空间结构是_______ 。
(2)传统合成氨工艺是将 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入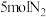 、
、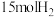 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
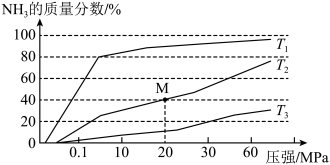
①温度 、
、 、
、 大小关系是
大小关系是_______ 。
②M点的平衡常数K=_______ (可用分数表示)。
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入 ,b处通入
,b处通入 。
。
①该装置中的能量转化形式是:_______ 能转化为_______ 能。
②导线中电子移动方向是_______ (填“a→b”或“b→a”)。
③相比传统工业合成氨,该方法的优点有_______ (任写一点)。
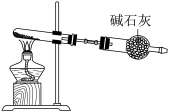
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
已知: 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
(5)温度为 时,将
时,将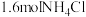 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:
①4~7min,HCl的平均反应速率为_______ 。
②其它条件不变,9min后,向容器中加入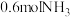 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,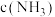
_______ (填“增大”、“减小”或“不变”)。
③下列描述中,可以表明该反应达到化学平衡状态的是_______ 。
A.容器中固体质量不变
B.容器中 的含量不变
的含量不变
C.容器中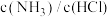 的比值不变
的比值不变
D.容器中气体压强不变
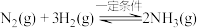
(1)
 的空间结构是
的空间结构是(2)传统合成氨工艺是将
 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入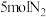 、
、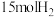 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
①温度
 、
、 、
、 大小关系是
大小关系是②M点的平衡常数K=
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入
 ,b处通入
,b处通入 。
。①该装置中的能量转化形式是:
②导线中电子移动方向是
③相比传统工业合成氨,该方法的优点有
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
已知:
 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
A. | B. | C. | D. |
 时,将
时,将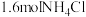 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:| t/min | 2 | 4 | 7 | 9 |
 | 0.4 | 0.5 | 0.6 | 0.6 |
②其它条件不变,9min后,向容器中加入
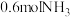 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,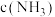
③下列描述中,可以表明该反应达到化学平衡状态的是
A.容器中固体质量不变
B.容器中
 的含量不变
的含量不变C.容器中
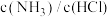 的比值不变
的比值不变 D.容器中气体压强不变
您最近一年使用:0次
解题方法
2 . 完成下列问题
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于___________ 键,水分子的VSEPR模型名称是___________ 。
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①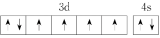 、②
、②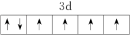 、③
、③ 、④
、④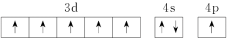 ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是___________ (填字母)。
A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸___________ 对羟基苯甲酸。
②pKa:CF3COOH___________ CH3COOH。
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3___________ ;___________ 。
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
(6)某烃的蒸气对H2的相对密度为21,该烃中碳元素的质量分数为85.7%,则该烃的分子式为___________ ,可能的结构简式为___________ 、___________ 。
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①
 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸
②pKa:CF3COOH
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3
②
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
| A.(CH3)2CHCH(CH3)2 | B.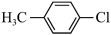 |
C.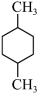 | D.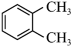 |
您最近一年使用:0次
名校
解题方法
3 . 锰酸锂(LiMn2O4) 可作为某锂离子电池的正极材料,工业上利用软锰矿浆(主要成分为 MnO2,含少量 Fe2O3、FeO、Al2O3、SiO2。等杂质)吸收含硫烟气(主要成分 SO2) 制备锰酸锂,生产流程如图所示:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
(1)含硫烟气中 SO2的VSEPR模型为___________ 。
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是___________ 。
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:___________ 。
(4)滤液1中所含金属阳离子除 以外还有
以外还有___________ (填离子符号)。
(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入___________ ,再加入NaOH溶液调节pH范围为___________ ,过滤得到滤液 2 和滤渣,请设计实验方案由滤渣制得纯净 Al(OH)3[Al(OH)3在 pH≥12时溶解]的实验方案:___________ 。
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:___________ 。
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:
 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为___________ 。

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气中 SO2的VSEPR模型为
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:
(4)滤液1中所含金属阳离子除
 以外还有
以外还有(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:

 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为
您最近一年使用:0次
4 . 化合物M由原子序数依次增大的前20号元素X、Y、Z组成,其中X、Y为同周期相邻元素。M是一种固体氮肥,又名石灰氮,属于离子化合物,阴、阳离子个数比为1:1。Z是构成动物骨骼和牙齿的重要元素,M中Z元素的质量分数为50%。下列说法正确的是
| A.简单氢化物的沸点:X>Y |
| B.X、Y所在周期的非金属元素有6种 |
| C.Z元素的最高价氧化物对应的水化物是一种弱碱 |
| D.M的阴离子中各原子均满足8电子稳定结构 |
您最近一年使用:0次
名校
5 . 请回答下列问题:
(1)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
(2)第四周期主族元素中,第一电离能介于Ga、As之间的元素有___________ 种。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是___________ 。
(4)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___________ 。
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Mg原子最近的Fe原子个数是___________ 。
②若该晶胞的晶胞边长为d nm,则该合金的密度为___________  。(不用化简)
。(不用化简)
③若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下H2的体积约为__________ 。
(1)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
| A.1s22s22p43s1 | B.1s22s22p43d2 | C.1s22s22p5 | D.1s22s22p6 |
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Mg原子最近的Fe原子个数是
②若该晶胞的晶胞边长为d nm,则该合金的密度为
 。(不用化简)
。(不用化简)③若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下H2的体积约为
您最近一年使用:0次
名校
解题方法
6 . 铝和硅在地壳中含量丰富,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)①基态Si原子的价电子排布式为______ 。
②Si所在周期中的非金属元素(Si、P、S、Cl),其第一电离能由小到大的顺序为______ 。
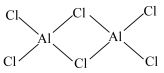
(2) 的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物
的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物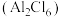 ,结构如图所示。
,结构如图所示。
①基态Al原子核外电子的空间运动状态有______ 种,
②二聚物中Al原子的杂化轨道类型为______ 杂化。
(3)Al—空气—海水原电池的正极反应式为________________________ 。
(4)铝和白磷在一定条件下可以制备磷化铝(AlP),其晶胞如图所示:
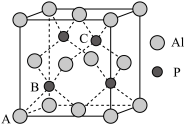
①晶胞中A1的配位数是______ ,
②若晶胞参数为apm, 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为______ 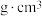 (列出表达式)。
(列出表达式)。
(5)以高硫铝土矿(主要成分为 ,少量
,少量 和金属硫酸盐)为原料,获得
和金属硫酸盐)为原料,获得 的部分工艺流程如下:
的部分工艺流程如下:

①焙烧过程均会产生 ,用
,用 溶液吸收过量
溶液吸收过量 的离子方程式为
的离子方程式为__________________ 。
②“过滤”得到的滤渣中含大量的 。
。 与
与 混合后在缺氧条件下焙烧生成
混合后在缺氧条件下焙烧生成 和
和 ,理论上完全反应消耗的
,理论上完全反应消耗的
______ 。
(1)①基态Si原子的价电子排布式为
②Si所在周期中的非金属元素(Si、P、S、Cl),其第一电离能由小到大的顺序为
(2)
 的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物
的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物 ,结构如图所示。
,结构如图所示。
①基态Al原子核外电子的空间运动状态有
②二聚物中Al原子的杂化轨道类型为
(3)Al—空气—海水原电池的正极反应式为
(4)铝和白磷在一定条件下可以制备磷化铝(AlP),其晶胞如图所示:

①晶胞中A1的配位数是
②若晶胞参数为apm,
 为阿伏加德罗常数,则该晶胞的密度为
为阿伏加德罗常数,则该晶胞的密度为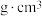 (列出表达式)。
(列出表达式)。(5)以高硫铝土矿(主要成分为
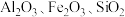 ,少量
,少量 和金属硫酸盐)为原料,获得
和金属硫酸盐)为原料,获得 的部分工艺流程如下:
的部分工艺流程如下:
①焙烧过程均会产生
 ,用
,用 溶液吸收过量
溶液吸收过量 的离子方程式为
的离子方程式为②“过滤”得到的滤渣中含大量的
 。
。 与
与 混合后在缺氧条件下焙烧生成
混合后在缺氧条件下焙烧生成 和
和 ,理论上完全反应消耗的
,理论上完全反应消耗的
您最近一年使用:0次
名校
解题方法
7 . 铼(Re)是生产飞机发动机叶片必不可少的材料。X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼。Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体。下列说法不正确的是
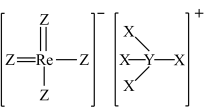
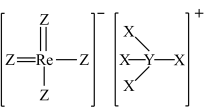
A.元素第一电离能: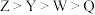 |
B.图中的阳离子与 互为等电子体,具有相同的空间结构 互为等电子体,具有相同的空间结构 |
| C.Q的最高价氧化物对应水化物可以和强碱反应 |
| D.熔点:W晶体小于W、Y形成的晶体 |
您最近一年使用:0次
2024-01-24更新
|
167次组卷
|
2卷引用:福建省三明第一中学2023-2024学年高三上学期12月月考化学试题
解题方法
8 .  为原子序数依次增大的五种短周期主族元素。液态
为原子序数依次增大的五种短周期主族元素。液态 可以作制冷剂,
可以作制冷剂, 是地壳中含量最多的元素。
是地壳中含量最多的元素。 与
与 同主族,
同主族, 是同周期原子半径最小的主族元素。下列说法正确的是
是同周期原子半径最小的主族元素。下列说法正确的是
 为原子序数依次增大的五种短周期主族元素。液态
为原子序数依次增大的五种短周期主族元素。液态 可以作制冷剂,
可以作制冷剂, 是地壳中含量最多的元素。
是地壳中含量最多的元素。 与
与 同主族,
同主族, 是同周期原子半径最小的主族元素。下列说法正确的是
是同周期原子半径最小的主族元素。下列说法正确的是A. 分子空间结构为平面正三角形 分子空间结构为平面正三角形 | B.最高化合价: |
C. 与 与 组成的一种化合物可以用作消毒剂 组成的一种化合物可以用作消毒剂 | D. 和 和 元素对应单质的晶体类型相同 元素对应单质的晶体类型相同 |
您最近一年使用:0次
2023-09-10更新
|
107次组卷
|
2卷引用:广东省清中、河中、北中、惠中、阳中、茂中等6校2023-2024学年高三上学期第一次联考化学试题
名校
解题方法
9 . 柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:
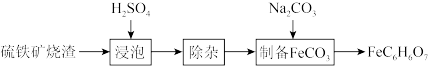
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
(1)“浸泡”时加入过量硫酸的目的:___________ 。
(2)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由___________ 。
途径一:
途径二: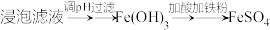
(3)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如下图:
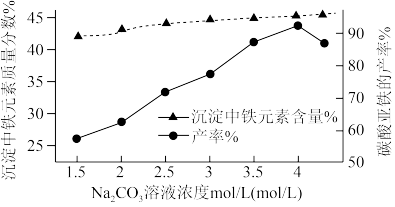
Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是:___________ 。
(4)在水溶液里,铁氰化钾K3[Fe(CN)6]与FeSO4生成蓝色沉淀,常用于Fe2+的检验。
①HCN分子、SO 离子的空间构型分别为
离子的空间构型分别为___________ 、___________ 。
②基态Fe3+的价电子排布图为___________ 。
③组成K3[Fe(CN)6]的各元素电负性由大到小的次序是___________ 。
④1mol铁氰化钾中σ键的数目为___________ mol。
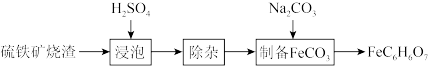
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
| 金属离子 | 沉淀开始pH | 沉淀完全pH |
| Al3+ | 3.1 | 5.1 |
| Fe2+ | 5.9 | 6.9 |
| Fe3+ | 1.2 | 3.2 |
(2)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
途径一:

途径二:
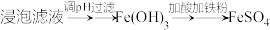
(3)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如下图:

Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是:
(4)在水溶液里,铁氰化钾K3[Fe(CN)6]与FeSO4生成蓝色沉淀,常用于Fe2+的检验。
①HCN分子、SO
 离子的空间构型分别为
离子的空间构型分别为②基态Fe3+的价电子排布图为
③组成K3[Fe(CN)6]的各元素电负性由大到小的次序是
④1mol铁氰化钾中σ键的数目为
您最近一年使用:0次
解题方法
10 . 前三周期主族元素X、Y、Z、R的原子序数依次增大,X是地壳中含量最高的元素,Y的p轨道电子总数比s轨道电子总数多1且p轨道有一个未成对电子,X的最外层电子数为Z的最外层电子数的三倍,Z、R、X的最外层电子数呈等差数列。下列叙述错误的是
| A.原子半径:Z>R>X>Y | B.RY4分子具有正四面体结构 |
| C.与氢形成的共价键键能:H−X>H−Y | D.Z与Y形成的化合物为离子化合物 |
您最近一年使用:0次
2023-08-31更新
|
81次组卷
|
4卷引用:湖南省百校2023-2024学年高三上学期8月联考化学试题



