解题方法
1 . 完成下列问题
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于___________ 键,水分子的VSEPR模型名称是___________ 。
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①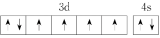 、②
、②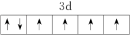 、③
、③ 、④
、④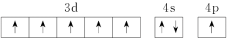 ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是___________ (填字母)。
A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸___________ 对羟基苯甲酸。
②pKa:CF3COOH___________ CH3COOH。
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3___________ ;___________ 。
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
(6)某烃的蒸气对H2的相对密度为21,该烃中碳元素的质量分数为85.7%,则该烃的分子式为___________ ,可能的结构简式为___________ 、___________ 。
(1)水分子中的共价键,依据原子轨道重叠的方式判断,属于
(2)由铁原子形成的四种微粒,价层电子轨道表示式分别为①
 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述不正确的是
,有关这些微粒的叙述不正确的是A.微粒半径:④>①>②
B.电离一个电子所需最低能量:②>①>④
C.微粒③价层电子在简并轨道中单独分占且自旋相同,故不能再继续失电子
(3)用“>”或“<”填空:
①沸点:邻羟基苯甲酸
②pKa:CF3COOH
(4)填写下列物质所含官能团的名称
①CH3C≡CCH3
②
(5)下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是___________。
| A.(CH3)2CHCH(CH3)2 | B.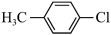 |
C.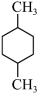 | D.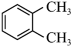 |
您最近一年使用:0次
名校
解题方法
2 . 化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是
| A.元素电负性:E>Y>Z | B.1mol M中含有共价键数目为4NA |
| C.半径:X2+>E2- | D.YZ3和YE 的空间结构均为三角锥形 的空间结构均为三角锥形 |
您最近一年使用:0次
名校
3 . 请回答下列问题:
(1)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
(2)第四周期主族元素中,第一电离能介于Ga、As之间的元素有___________ 种。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是___________ 。
(4)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___________ 。
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Mg原子最近的Fe原子个数是___________ 。
②若该晶胞的晶胞边长为d nm,则该合金的密度为___________  。(不用化简)
。(不用化简)
③若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下H2的体积约为__________ 。
(1)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
| A.1s22s22p43s1 | B.1s22s22p43d2 | C.1s22s22p5 | D.1s22s22p6 |
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离Mg原子最近的Fe原子个数是
②若该晶胞的晶胞边长为d nm,则该合金的密度为
 。(不用化简)
。(不用化简)③若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下H2的体积约为
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
4 . 化合物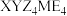 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为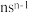 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是
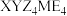 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族,且Y的原子半径小于M。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为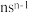 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是A.元素电负性: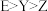 | B.简单氢化物沸点: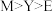 |
C.第一电离能: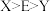 | D.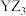 和 和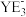 空间结构均为三角锥形 空间结构均为三角锥形 |
您最近一年使用:0次
5 . 请回答下列问题:
(1)I 离子的立体构型是
离子的立体构型是___________ 。
(2)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
(3)第四周期主族元素中,第一电离能介于Ga、As之间的元素有___________ 种。
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是___________ 。
(5)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___________ 。
(1)I
 离子的立体构型是
离子的立体构型是(2)下列氟元素的不同微粒,用光谱仪可捕捉到发射光谱的是___________。
| A.1s22s22p43s1 | B.1s22s22p43d2 | C.1s22s22p5 | D.1s22s22p6 |
(3)第四周期主族元素中,第一电离能介于Ga、As之间的元素有
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(5)氧是地壳中含量最多的元素。H+可与H2O形成H3O+,H3O+中H-O-H键角比H2O中H-O-H键角大,原因为
您最近一年使用:0次
名校
解题方法
6 . 柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:
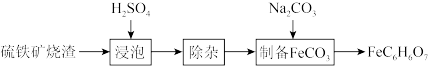
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
(1)“浸泡”时加入过量硫酸的目的:___________ 。
(2)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由___________ 。
途径一:
途径二: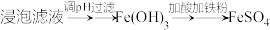
(3)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如下图:
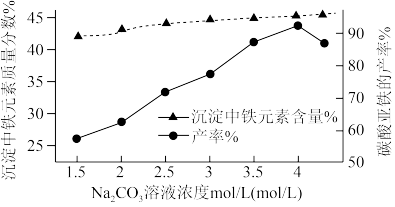
Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是:___________ 。
(4)在水溶液里,铁氰化钾K3[Fe(CN)6]与FeSO4生成蓝色沉淀,常用于Fe2+的检验。
①HCN分子、SO 离子的空间构型分别为
离子的空间构型分别为___________ 、___________ 。
②基态Fe3+的价电子排布图为___________ 。
③组成K3[Fe(CN)6]的各元素电负性由大到小的次序是___________ 。
④1mol铁氰化钾中σ键的数目为___________ mol。
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
| 金属离子 | 沉淀开始pH | 沉淀完全pH |
| Al3+ | 3.1 | 5.1 |
| Fe2+ | 5.9 | 6.9 |
| Fe3+ | 1.2 | 3.2 |
(2)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
途径一:

途径二:
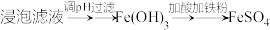
(3)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如下图:

Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是:
(4)在水溶液里,铁氰化钾K3[Fe(CN)6]与FeSO4生成蓝色沉淀,常用于Fe2+的检验。
①HCN分子、SO
 离子的空间构型分别为
离子的空间构型分别为②基态Fe3+的价电子排布图为
③组成K3[Fe(CN)6]的各元素电负性由大到小的次序是
④1mol铁氰化钾中σ键的数目为
您最近一年使用:0次
7 . C、H、O、N是四种常见的非金属元素,其单质及化合物在诸多领域中都有广泛的应用。回答下列问题:
(1)基态碳原子的轨道表示式为___________ 。
(2)乙醇分子中碳原子的杂化方式为___________ ,1mol乙醇分子中含有 键的数目为
键的数目为___________ ( 为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、
为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、___________ 。
(3) 分子的空间构型为
分子的空间构型为___________ , 的键角
的键角___________ (填“>”或“<”) 的键角。
的键角。
(4)丙氨酸(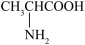 )是蛋白质中含量最高的α型氨基酸,该分子中含
)是蛋白质中含量最高的α型氨基酸,该分子中含___________ 个手性碳原子。
(1)基态碳原子的轨道表示式为
(2)乙醇分子中碳原子的杂化方式为
 键的数目为
键的数目为 为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、
为阿伏加德罗常数的值)。乙醇与水互溶,其原因是乙醇与水分子间形成氢键、(3)
 分子的空间构型为
分子的空间构型为 的键角
的键角 的键角。
的键角。(4)丙氨酸(
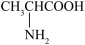 )是蛋白质中含量最高的α型氨基酸,该分子中含
)是蛋白质中含量最高的α型氨基酸,该分子中含
您最近一年使用:0次
名校
解题方法
8 . MBTH(熔点 )常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:
)常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:

回答下列问题
(1)甲醛所含元素的电负性由小到大的顺序为___________ (用元素符号表示),基态 原子的价层电子轨道表示式为
原子的价层电子轨道表示式为___________
(2)甲醛分子的VSEPR模型为___________ ,甲醛沸点(19.5℃)低于甲醇沸点(64.8℃),其原因是___________ 。
(3)甲醛能和一些极性试剂如 进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为
进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为___________ 。
(4)MBTH分子中碳原子采取的杂化类型为___________ ,基态 原子核外电子有
原子核外电子有___________ 种空间运动状态(原子轨道)。
(5) 与
与 的比较,熔点更高的是
的比较,熔点更高的是___________ 。
(6)下列现代分析手段中,可用于检测MBTH的分子结构的是___________。
 )常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:
)常用于检测室内空气中甲醛(HCHO)含量,结构如图所示:
回答下列问题
(1)甲醛所含元素的电负性由小到大的顺序为
 原子的价层电子轨道表示式为
原子的价层电子轨道表示式为(2)甲醛分子的VSEPR模型为
(3)甲醛能和一些极性试剂如
 进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为
进行加成反应(氢原子加到电负性相对大的氧原子上),该反应的化学方程式为(4)MBTH分子中碳原子采取的杂化类型为
 原子核外电子有
原子核外电子有(5)
 与
与 的比较,熔点更高的是
的比较,熔点更高的是(6)下列现代分析手段中,可用于检测MBTH的分子结构的是___________。
| A.X射线衍射 | B.原子光谱 | C.元素分析 | D.红外光谱 |
您最近一年使用:0次
2023-05-15更新
|
228次组卷
|
2卷引用:广东省广州市第六十五中学2022-2023学年高二下学期期中考试化学试题
名校
9 . 某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成。五种元素分处三个短周期,且包含地壳中含量前三的三种元素。五种元素原子的最外层电子数之和为20。下列说法正确的是
A.简单离子半径: |
B.最简单氢化物的稳定性: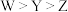 |
| C.R分别与W、Z形成的三原子分子均为V形分子 |
D.常见单质的熔点: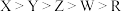 |
您最近一年使用:0次
名校
解题方法
10 . 现有X、Y、Z、T四种短周期元素,原子序数依次增大。请根据下列相关信息,回答问题。
(1)Z2X4分子中Z原子采取____ 杂化,写出与之互为等电子体的有机物的结构简式_____
(2)Cl2T分子的空间构型____ ,Z2T的电子式____ 。
(3)请用价层电子对互斥理论解释ZX 和ZX3的键角∠XZX的大小:
和ZX3的键角∠XZX的大小:___ 。
| 元素 | 相关信息 |
| X | 原子的1s轨道上只有1个电子 |
| Y | 原子的L层上s电子数等于p电子数 |
| Z | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且T的质量分数为88.9% |
(1)Z2X4分子中Z原子采取
(2)Cl2T分子的空间构型
(3)请用价层电子对互斥理论解释ZX
 和ZX3的键角∠XZX的大小:
和ZX3的键角∠XZX的大小:
您最近一年使用:0次



