9-10高二下·福建漳州·期末
名校
解题方法
1 . 下列叙述正确的是
A. 是极性分子,分子中氮原子是在3个氢原子所构成的三角形的中心 是极性分子,分子中氮原子是在3个氢原子所构成的三角形的中心 |
B. 是非极性分子,分子中碳原子处在4个氯原子所构成的正方形的中心 是非极性分子,分子中碳原子处在4个氯原子所构成的正方形的中心 |
C. 是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中间 是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中间 |
D. 是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的中间 是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的中间 |
您最近一年使用:0次
2021-02-16更新
|
954次组卷
|
40卷引用:2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷
2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷(已下线)2010年福建省华安一中高二下学期期末考试化学试题(已下线)2011届上海市南汇中学高三上学期期中考试化学卷(已下线)2010-2011学年山西省吕梁市高二下学期期中考试化学试卷(已下线)2011-2012学年江苏省泰州中学高二上学期期中考试化学(选修)试卷(已下线)2011-2012学年甘肃省甘谷一中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省四地六校高二下学期第三次月考化学试卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷2015-2016学年湖北省黄石市有色一中高二下学期期中考试化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--分子空间结构与物质性质河南省济源第一中学2017-2018学年高二下期6月月考化学试题(已下线)2018年11月30日 《每日一题》一轮复习-键的极性与分子的极性云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二下学期第一次月考化学试题(已下线)2019年4月12日 《每日一题》选修3-分子的极性判断吉林省吉林市第五十五中学2018-2019学年高二下学期3月月考化学试题【全国百强校】贵州省思南中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高二下学期期中考试化学试题【校级联考】福建省宁德市高中同心顺联盟校2018-2019学年高二下学期期中考试化学试题甘肃省临泽一中2018-2019学年高二下学期期末模拟化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题贵州省罗甸县第一中学2019-2020学年高二上学期期末考试化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题课时3 分子的空间构型与分子性质——A学习区 夯实基础(鲁科版选修3)宁夏回族自治区银川一中2019-2020学年高二下学期期中考试化学试题山西省太原市实验中学校2019-2020学年高二下学期期中考试化学试题河北省唐山市开滦第二中学2019-2020学年高二6月月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质 第1课时 共价键的极性高二选择性必修2(人教版2019)第二章 分子结构与性质 第三节 分子结构与物质的性质 课时1 共价键的极性(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构 第2课时 分子的空间结构与分子性质山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题人教2019选择性必修2第二章第三节 分子结构与物质的性质课后习题(已下线)第31讲 分子结构与性质(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)福建省三明市五县2021-2022学年高二下学期联合质检考试(期中)化学试题安徽省滁州市定远县炉桥中学2021-2022学年高二下学期期末考试化学试卷2019鲁科版高中化学选择性必修2第2章第2节 共价键与分子的空间结构课后习题福建省宁德第一中学2022-2023学年高二下学期3月月考化学试题北京师范大学附属中学2023-2024学年高二下学期期中考试化学试题
2 . (1)基态Fe原子的简化电子排布式为______________________ 。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式______________ ;Fe(CO)5分子中σ键与π键之比为______________ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是_____________ ;(SCN)2分子中硫原子的杂化方式是_____________ ;
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_________________ 。
②与NH3互为等电子体的一种阴离子为_____________ (填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__________ 。
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________ 。
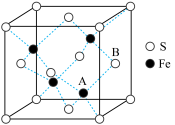
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为___________________ ;A原子距离B原子所在立方体侧面的最短距离为________________ pm(用x表示); 该晶胞的密度为____________ g·cm-3。(阿伏加 德罗常数用NA表示)
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中第一电离能最大的元素是
(4)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是
②与NH3互为等电子体的一种阴离子为
(5)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为
(6)铁和硫形成的某种晶胞结构如右图所示,晶胞参数a=xpm,则该物质的化学式为

您最近一年使用:0次
解题方法
3 . 铝试剂:(NH4)3C19H8(OH)3(COO)3,其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:
(1)碳原子价层电子的电子排布图_______ 。
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是____________ ;氮元素的第一电离能呈现异常的原因是____ 。
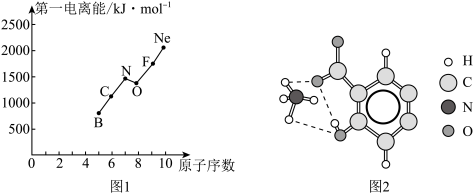
(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为_________ ,不同之处为_________ 。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为_______ 个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________ 。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、____________ 、____________ 。
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为______________ (NA表示阿伏加 德罗常数的值)。
(1)碳原子价层电子的电子排布图
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是

(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为
您最近一年使用:0次
名校
4 . 下列描述正确的是( )
| A.水加热到很高温度都难分解是因水分子间存在氢键 |
| B.C2H2分子中σ键与π键的数目比为1∶1 |
| C.CS2为V形极性分子 |
| D.SiF4与SO32-的中心原子均为sp3杂化 |
您最近一年使用:0次
2018-07-25更新
|
220次组卷
|
3卷引用:【全国校级联考】辽宁省抚顺市六校2017-2018学年高二下学期期末考试化学试题
【全国校级联考】辽宁省抚顺市六校2017-2018学年高二下学期期末考试化学试题湖南省沅陵县第一中学2021-2022学年高二下学期入学考试化学试题(已下线)题型02 分子的空间构型及杂化类型的判断-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)



