解题方法
1 . 亚氯酸钠(NaClO2)是高效氧化剂和漂白剂,其制备流程如下:
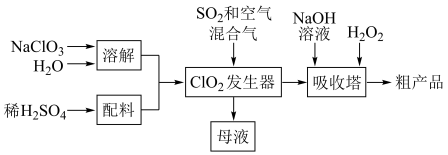
已知:
① NaClO2在温度高于60 °C时易分解生成NaClO3和NaCl。
②ClO2(沸点11 ℃)浓度高时易发生分解爆炸,可用气体稀释至含量10 %以下。
ClO2极易溶于水。ClO 在酸性溶液中发生歧化反应,离子方程式为:5ClO
在酸性溶液中发生歧化反应,离子方程式为:5ClO +4H+
+4H+ 4ClO2↑+Cl-+2H2O
4ClO2↑+Cl-+2H2O
(1)根据价层电子对互斥理论,预测ClO 离子的空间结构是___________。
离子的空间结构是___________。
(2)推测发生器中鼓入空气的作用可能是___________ 。
(3)①若吸收塔内反应过程中转移2NA个电子,则生成标准状况下氧气的体积为___________ L。
A.11.2 B.22.4 C.33.6 D.44.8
②吸收塔的温度需控制在10℃以下,其原因是___________ 、___________ (列举两点)。
(4)28.25℃时,HClO2、HClO的电离平衡常数分别为:Ka(HClO2)=1.1×10-2、Ka(HClO) =2.98×10-8,常温下,等体积等物质的量浓度的NaClO2 、NaClO两种溶液,下列说法正确的是___________
(5)取0.5 mol·L-1 NaClO2溶液,调节溶液pH=5,再加入适量AgNO3溶液,发现灭菌效果明显增强,请用化学平衡移动原理解释原因。___________
(6)已知NaClO2的溶解度随温度变化曲线如图所示。

①从NaClO2溶液中获得NaClO2无水晶体的过程中对温度的控制要求较高。操作时先减压,再将NaClO2溶液加热浓缩,浓缩时的最佳温度为___________ 。
A.略低于38 ℃ B.略高于38 ℃
C.略低于60 ℃ D.略高于60 ℃
②当加热浓缩至有晶膜出现时,再在常压下___________ (填操作)、过滤、洗涤、干燥。
上述NaClO2产品的纯度测定实验为:称取m g样品溶解后、加入稍过量的KI,再滴加适量的稀硫酸,充分反应后,稀释为500 mL溶液,再移取25.00 mL上述溶液,用c mol·L−1 Na2S2O3标准溶液滴定,终点时消耗V mL,有关实验原理:ClO +4I-+4H+= 2H2O+2I2+Cl-、I2+2S2O
+4I-+4H+= 2H2O+2I2+Cl-、I2+2S2O =2I-+S4O
=2I-+S4O 。
。
(7)计算该NaClO2产品的纯度______ (用含m、c、V的代数式表示,写出计算过程)。

已知:
① NaClO2在温度高于60 °C时易分解生成NaClO3和NaCl。
②ClO2(沸点11 ℃)浓度高时易发生分解爆炸,可用气体稀释至含量10 %以下。
ClO2极易溶于水。ClO
 在酸性溶液中发生歧化反应,离子方程式为:5ClO
在酸性溶液中发生歧化反应,离子方程式为:5ClO +4H+
+4H+ 4ClO2↑+Cl-+2H2O
4ClO2↑+Cl-+2H2O(1)根据价层电子对互斥理论,预测ClO
 离子的空间结构是___________。
离子的空间结构是___________。| A.直线形 | B.V形 | C.平面三角形 | D.正四面体形 |
(2)推测发生器中鼓入空气的作用可能是
(3)①若吸收塔内反应过程中转移2NA个电子,则生成标准状况下氧气的体积为
A.11.2 B.22.4 C.33.6 D.44.8
②吸收塔的温度需控制在10℃以下,其原因是
(4)28.25℃时,HClO2、HClO的电离平衡常数分别为:Ka(HClO2)=1.1×10-2、Ka(HClO) =2.98×10-8,常温下,等体积等物质的量浓度的NaClO2 、NaClO两种溶液,下列说法正确的是___________
| A.碱性:NaClO2 > NaClO | B.离子总数:NaClO2 > NaClO |
C.2 c(Na+)=c(ClO-)+c(ClO ) ) | D. c(ClO )+c(HClO2)=c(ClO-)+c(HClO) )+c(HClO2)=c(ClO-)+c(HClO) |
(5)取0.5 mol·L-1 NaClO2溶液,调节溶液pH=5,再加入适量AgNO3溶液,发现灭菌效果明显增强,请用化学平衡移动原理解释原因。
(6)已知NaClO2的溶解度随温度变化曲线如图所示。

①从NaClO2溶液中获得NaClO2无水晶体的过程中对温度的控制要求较高。操作时先减压,再将NaClO2溶液加热浓缩,浓缩时的最佳温度为
A.略低于38 ℃ B.略高于38 ℃
C.略低于60 ℃ D.略高于60 ℃
②当加热浓缩至有晶膜出现时,再在常压下
上述NaClO2产品的纯度测定实验为:称取m g样品溶解后、加入稍过量的KI,再滴加适量的稀硫酸,充分反应后,稀释为500 mL溶液,再移取25.00 mL上述溶液,用c mol·L−1 Na2S2O3标准溶液滴定,终点时消耗V mL,有关实验原理:ClO
 +4I-+4H+= 2H2O+2I2+Cl-、I2+2S2O
+4I-+4H+= 2H2O+2I2+Cl-、I2+2S2O =2I-+S4O
=2I-+S4O 。
。(7)计算该NaClO2产品的纯度
您最近一年使用:0次
2 . 废气中的 通过高温热分解可制取氢气:
通过高温热分解可制取氢气: 。现在3L密闭容器中,控制不同温度进行
。现在3L密闭容器中,控制不同温度进行 分解实验。
分解实验。
(1)硫化氢分子的空间构型为_______ 。
(2)某温度时,测得反应体系中有气体1.31mol,反应t min后,测得气体为1.37mol,则t min内 的生成速率为
的生成速率为_______ 。
(3)某温度时, 的转化率达到最大值的依据是
的转化率达到最大值的依据是_______ (选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c. 不发生变化 d.单位时间里分解的
不发生变化 d.单位时间里分解的 和生成的
和生成的 一样多
一样多
(4)实验结果如图,图中曲线a表示 的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且末达到化学平衡时
的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且末达到化学平衡时 的转化率,该反应为
的转化率,该反应为_______ 反应(填“放热”或“吸热”);曲线b随温度的升高,向曲线a逼近的原因是_______ ;在容器不变的情况下,如果要提高 的体积分数,可采取的一种措施是
的体积分数,可采取的一种措施是_______ 。

(5)使1L 与20L空气(空气中
与20L空气(空气中 体积分数为0.2)完全反应后恢复到室温,混合气体的体积是
体积分数为0.2)完全反应后恢复到室温,混合气体的体积是_______ L。若2g 完全燃烧后生成二氧化硫和水蒸气,同时放出29.4kJ的热量,该反应的热化学方程式是
完全燃烧后生成二氧化硫和水蒸气,同时放出29.4kJ的热量,该反应的热化学方程式是_______ 。
 通过高温热分解可制取氢气:
通过高温热分解可制取氢气: 。现在3L密闭容器中,控制不同温度进行
。现在3L密闭容器中,控制不同温度进行 分解实验。
分解实验。(1)硫化氢分子的空间构型为
(2)某温度时,测得反应体系中有气体1.31mol,反应t min后,测得气体为1.37mol,则t min内
 的生成速率为
的生成速率为(3)某温度时,
 的转化率达到最大值的依据是
的转化率达到最大值的依据是a.气体的压强不发生变化 b.气体的密度不发生变化
c.
 不发生变化 d.单位时间里分解的
不发生变化 d.单位时间里分解的 和生成的
和生成的 一样多
一样多(4)实验结果如图,图中曲线a表示
 的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且末达到化学平衡时
的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且末达到化学平衡时 的转化率,该反应为
的转化率,该反应为 的体积分数,可采取的一种措施是
的体积分数,可采取的一种措施是
(5)使1L
 与20L空气(空气中
与20L空气(空气中 体积分数为0.2)完全反应后恢复到室温,混合气体的体积是
体积分数为0.2)完全反应后恢复到室温,混合气体的体积是 完全燃烧后生成二氧化硫和水蒸气,同时放出29.4kJ的热量,该反应的热化学方程式是
完全燃烧后生成二氧化硫和水蒸气,同时放出29.4kJ的热量,该反应的热化学方程式是
您最近一年使用:0次



