1 . 有下列五种物质:
① ②
② ③CH3OH④CH3COOH⑤
③CH3OH④CH3COOH⑤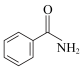
回答问题(1)~(4):
(1)①中碳原子杂化方式分别是_____ 。②中官能团名称是_____ 。
(2)写出②转化成丙烯的化学方程式_____ 。
(3)写出③与④反应的化学方程式_____ 。
(4)⑤在氢氧化钠溶液中反应的化学方程式是_____ 。
(5)下列三组物质能用酸性高锰酸钾溶液鉴别的一组物质是_____ (填字母序号)。
a.乙烯和乙炔 b.乙烯和乙烷 c.苯和环己烷
(6)普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是_____ (填字母序号)。
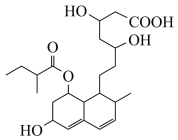
a.该物质能与Na、NaHCO3发生反应
b.能与FeCl3溶液发生显色反应
c.能发生加成、取代、消去反应
d.1mol该物质最多可与1molNaOH反应
①
 ②
② ③CH3OH④CH3COOH⑤
③CH3OH④CH3COOH⑤
回答问题(1)~(4):
(1)①中碳原子杂化方式分别是
(2)写出②转化成丙烯的化学方程式
(3)写出③与④反应的化学方程式
(4)⑤在氢氧化钠溶液中反应的化学方程式是
(5)下列三组物质能用酸性高锰酸钾溶液鉴别的一组物质是
a.乙烯和乙炔 b.乙烯和乙烷 c.苯和环己烷
(6)普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是

a.该物质能与Na、NaHCO3发生反应
b.能与FeCl3溶液发生显色反应
c.能发生加成、取代、消去反应
d.1mol该物质最多可与1molNaOH反应
您最近一年使用:0次
2023-07-27更新
|
165次组卷
|
2卷引用:北京市大兴区2022-2023学年高二下学期期末考试化学试题
2 . 酒石酸(C4H6O6)是一种有机酸,其分子结构模型如图。下列说法不正确 的是
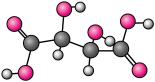

| A.酒石酸中各元素的电负性由大到小的顺序为O>C>H |
| B.酒石酸中碳原子有sp2、sp3两种杂化方式 |
| C.1 mol酒石酸最多能与2 mol 金属钠发生反应 |
| D.常温下,酒石酸钾水溶液pH>7,说明酒石酸是弱酸 |
您最近一年使用:0次
解题方法
3 . 研究发现, 低压合成甲醇的反应:
低压合成甲醇的反应: ,钴氧化物负载的锰氧化物纳米粒子催化剂具有较高的活性,有良好的应用前景。
,钴氧化物负载的锰氧化物纳米粒子催化剂具有较高的活性,有良好的应用前景。
(1) 分子和
分子和 分子中,
分子中, 原子的杂化轨道类型分别为
原子的杂化轨道类型分别为______________ 和______________ 。
(2) 和
和 中,沸点较高的是
中,沸点较高的是_____________ ,从结构角度分析,原因是______________________ 。
(3)基态锰原子的价层电子排布式为_______________ 。
(4)工业上利用甲醇空气氧化法生产甲醛(HCHO)。下列关于甲醛分子的说法正确的是____________ (填序号)。
a.碳氧双键中有一个 键,一个
键,一个 键
键
b.中心原子的孤电子对数为0
c.甲醛分子为极性分子
d.甲醛的VSEPR模型为平面三角形
 低压合成甲醇的反应:
低压合成甲醇的反应: ,钴氧化物负载的锰氧化物纳米粒子催化剂具有较高的活性,有良好的应用前景。
,钴氧化物负载的锰氧化物纳米粒子催化剂具有较高的活性,有良好的应用前景。(1)
 分子和
分子和 分子中,
分子中, 原子的杂化轨道类型分别为
原子的杂化轨道类型分别为(2)
 和
和 中,沸点较高的是
中,沸点较高的是(3)基态锰原子的价层电子排布式为
(4)工业上利用甲醇空气氧化法生产甲醛(HCHO)。下列关于甲醛分子的说法正确的是
a.碳氧双键中有一个
 键,一个
键,一个 键
键b.中心原子的孤电子对数为0
c.甲醛分子为极性分子
d.甲醛的VSEPR模型为平面三角形
您最近一年使用:0次
解题方法
4 . 下列说法不正确 的是
| A.核苷酸是组成核酸的基本单元 |
| B.麦芽糖既能发生水解反应又能发生银镜反应 |
C.油脂氢化后产生的人造脂肪中碳原子均为 杂化 杂化 |
| D.由纤维素制备纤维素乙酸酯时,纤维素中的羟基发生了酯化反应 |
您最近一年使用:0次
解题方法
5 . 下列说法不正确 的是
| A.p轨道形状为哑铃形,有三种空间取向 |
| B.金属良好的导电性与金属键有关 |
| C.HCl分子的共价键是s-s σ键 |
| D.NH4Cl中含有离子键、共价键和配位键 |
您最近一年使用:0次
名校
解题方法
6 . 某有机物结构如下图,关于该有机分子,下列说法不正确 的是
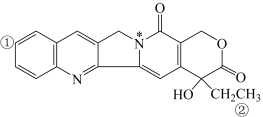

| A.O—H键极性强于C—H键 | B.①号碳原子和②号碳原子杂化类型相同 |
| C.该分子中含有手性碳原子,具有旋光性 | D.带*的氮原子能与 以配位键结合 以配位键结合 |
您最近一年使用:0次
名校
解题方法
7 . 酒石酸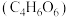 是一种有机弱酸,其分子结构模型如图。下列说法
是一种有机弱酸,其分子结构模型如图。下列说法不正确 的是
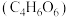 是一种有机弱酸,其分子结构模型如图。下列说法
是一种有机弱酸,其分子结构模型如图。下列说法
| A.酒石酸中各元素的电负性由大到小的顺序为O>C>H |
B.酒石酸中碳原子有 、 、 两种杂化方式 两种杂化方式 |
C. 酒石酸最多能与 酒石酸最多能与 金属钠发生反应 金属钠发生反应 |
D.常温下,酒石酸氢钾水溶液 ,说明酒石酸氢根的电离程度大于其水解程度 ,说明酒石酸氢根的电离程度大于其水解程度 |
您最近一年使用:0次
2023-01-06更新
|
373次组卷
|
4卷引用:北京市东城区2022-2023学年高三上学期1月期末统一检测化学试卷
名校
8 . 下列关于HCHO及构成微粒的化学用语或图示表达不正确 的是
A.O的原子结构示意图: | B.基态C原子的轨道表示式: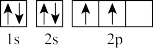 |
C.C原子杂化轨道示意图: | D.HCHO的分子结构模型: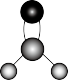 |
您最近一年使用:0次
2022-11-04更新
|
346次组卷
|
4卷引用:北京十中2022-2023学年高三上学期期末统练3化学试题
名校
解题方法
9 . 某 分子的片段如图所示。下列关于该片段的说法
分子的片段如图所示。下列关于该片段的说法不正确 的是

 分子的片段如图所示。下列关于该片段的说法
分子的片段如图所示。下列关于该片段的说法
| A.图示片段包含1个胞嘧啶、1个鸟嘌呤 |
B.该片段中所有氮原子都采取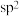 杂化 杂化 |
| C.该片段在一定条件下可发生水解反应 |
| D.若脱氧核糖中3号C所连羟基被还原为H原子,其参与形成的核苷酸将无法聚合为核酸 |
您最近一年使用:0次
2022-10-20更新
|
512次组卷
|
3卷引用:北京市第八十中学2022-2023学年高三上学期期末测试化学试题
北京市第八十中学2022-2023学年高三上学期期末测试化学试题北京市中国人民大学附属中学2022-2023学年高三上学期期中考试化学模拟试卷试题(已下线)模拟卷08-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)
10 . 中学常见的6种有机化合物:乙烷、乙烯、1-溴丙烷、1-丙醇、乙酸、乙酸乙酯。
(1)物质结构
① 6种物质的分子中只含有σ键的是___________ 。
② 6种物质中,碳原子的杂化方式均为sp2杂化的是___________ 。
(2)物理性质
①常温下,乙醇的溶解性大于苯酚,从结构角度分析其原因:___________ 。
②从物质结构角度解释乙酸的沸点高于1-丙醇的原因:___________ 。
(3)反应类型
①1-溴丙烷生成丙烯的化学方程式为___________ ,反应类型为___________ 。
②1-溴丙烷与氨气发生取代反应的产物中,有机化合物的结构简式可能是___________ 。
(4)物质制备
乙酸乙酯广泛用于药物、染料、香料等工业。实验室用无水乙醇、冰醋酸和浓硫酸反应可制备乙酸乙酯,常用装置如下图。

①写出无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式___________ 。
②试管X中的试剂为___________ 。
③为提高反应速率或限度,实验中采取的措施及对应理由不正确 的是___________ (填字母)。
a.浓硫酸可做催化剂,提高化学反应速率
b.浓硫酸可做吸水剂,促进反应向生成乙酸乙酯的反应移动
c.已知该反应为放热反应,升高温度可同时提高化学反应速率和反应限度
④ 写出3种不同物质类别的乙酸乙酯的同分异构体的结构简___________ 、___________ 、___________ 。
(1)物质结构
① 6种物质的分子中只含有σ键的是
② 6种物质中,碳原子的杂化方式均为sp2杂化的是
(2)物理性质
①常温下,乙醇的溶解性大于苯酚,从结构角度分析其原因:
②从物质结构角度解释乙酸的沸点高于1-丙醇的原因:
| 物质 | 相对分子质量 | 沸点 |
| 1-丙醇 | 60 | 97.4℃ |
| 乙酸 | 60 | 118℃ |
(3)反应类型
①1-溴丙烷生成丙烯的化学方程式为
②1-溴丙烷与氨气发生取代反应的产物中,有机化合物的结构简式可能是
(4)物质制备
乙酸乙酯广泛用于药物、染料、香料等工业。实验室用无水乙醇、冰醋酸和浓硫酸反应可制备乙酸乙酯,常用装置如下图。

①写出无水乙醇、冰醋酸和浓硫酸反应制备乙酸乙酯的化学方程式
②试管X中的试剂为
③为提高反应速率或限度,实验中采取的措施及对应理由
a.浓硫酸可做催化剂,提高化学反应速率
b.浓硫酸可做吸水剂,促进反应向生成乙酸乙酯的反应移动
c.已知该反应为放热反应,升高温度可同时提高化学反应速率和反应限度
④ 写出3种不同物质类别的乙酸乙酯的同分异构体的结构简
您最近一年使用:0次



