1 . 羟基亚乙基二磷酸(HEDPA,结构式如下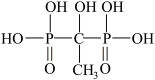 ,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
(1)根据元素分析数据,推证配合物A的分子式为____ 。
(2)画出该配合物的结构示意图,并在图上注明HEDPA中哪些原子可为配位原子?(用*表示)____ 。
(3)实验测得配合物A的磁矩为6.12μ0,配合物未成对电子数为___ ,中心原子的杂化轨道类型是____ 。
(4)如何将合成A的条件作修改,可得到多核配合物___ ,写出2种该多核配合物的分子式__ 。
(5)已知配合物[Mn(H2O)6]2+的d-d跃迁在400nm-550nm范围内有弱的吸收,配合物呈肉粉色,在水溶液中形成配合物后,中心离子的晶体场分裂能将发生怎样的变化____ 。观察配合物的颜色明显加深,为什么?___ 。
 ,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。
,可简写为H4L)可在较宽的pH范围内与金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250°C以上样品失重25.80%,脱水结束后对残余物之进行元素分析,配合物A的元素含量为:Mn(15.74%)、C(6.88%)、H(4.62%)、O(55.01%)、P(17.77%)。(1)根据元素分析数据,推证配合物A的分子式为
(2)画出该配合物的结构示意图,并在图上注明HEDPA中哪些原子可为配位原子?(用*表示)
(3)实验测得配合物A的磁矩为6.12μ0,配合物未成对电子数为
(4)如何将合成A的条件作修改,可得到多核配合物
(5)已知配合物[Mn(H2O)6]2+的d-d跃迁在400nm-550nm范围内有弱的吸收,配合物呈肉粉色,在水溶液中形成配合物后,中心离子的晶体场分裂能将发生怎样的变化
您最近一年使用:0次
解题方法
2 . (1)氮化硼(BN)是一种用途广泛的无机非金属材料,常见有立方氮化硼与六方氮化硼两种结构。六方氮化硼是一种白色难熔的耐高温物质,它具有类似石墨层状结构,被成为白石墨,常用作润滑剂,虽然六方氮化硼结构与石墨相似,但六方氮化硼却并不导电,具有优良的绝缘性能。立方氮化硼是棕色或暗红色的晶体,为闪锌矿结构,硬度仅次于金刚石,具有很高的热稳定性和化学惰性,因此,立方氮化硼磨具的磨削性能十分优异。
①写出氮化硼中B和N的基态电子排布式_______ 。
②氮化硼非常稳定,在红热时才能与水蒸气发生水解反应,写出该化学方程式_______ 。
③H3BO3是一元酸,试从分子结构角度解释原因_______ 。
④判断六方氮化硼中B与N的杂化类型_______ 、_______ 。
⑤从化学键角度解释为什么六方氮化硼的结构与石墨相似,但六方氮化硼却并不导电_______ 。
(2)PH3可由白磷(P4)和氢气反应生成。已知键能:P-P:213kJ·mol-1,H-H:435kJ·mol-1,P-H:326kJ·mol-1。
①画出白磷的结构式(空间结构)_______ 。
②写出所对应反应的化学方程式_______ 。
③根据键能计算该反应的焓变(反应物和产物均为气态,写出简要的计算过程)_______ 。
(3)锡的利用在我国有几千年历史,青铜器中就含有锡,殷墟中还出土过锡制品。锡的熔点232℃,有两种常见的同素异形体一白锡和灰锡,二者在一定温度下可以相互转化。
①锡的密度为7.28g·cm-3,晶胞参数a=583pmc=318pm,延展性好,质软。通过计算求出一个白锡晶胞中的锡原子数_______ 。
②灰锡的密度为5.75g·cm-3,有金刚石的结构。灰锡和白锡的部分热力学数据如下:
通过计算说明常温(25℃)时,灰锡和白锡哪种更稳定_______ ;
③锡做的茶叶罐不能放在冰箱中冷冻保存,通过计算说明原因_______ 。
①写出氮化硼中B和N的基态电子排布式
②氮化硼非常稳定,在红热时才能与水蒸气发生水解反应,写出该化学方程式
③H3BO3是一元酸,试从分子结构角度解释原因
④判断六方氮化硼中B与N的杂化类型
⑤从化学键角度解释为什么六方氮化硼的结构与石墨相似,但六方氮化硼却并不导电
(2)PH3可由白磷(P4)和氢气反应生成。已知键能:P-P:213kJ·mol-1,H-H:435kJ·mol-1,P-H:326kJ·mol-1。
①画出白磷的结构式(空间结构)
②写出所对应反应的化学方程式
③根据键能计算该反应的焓变(反应物和产物均为气态,写出简要的计算过程)
(3)锡的利用在我国有几千年历史,青铜器中就含有锡,殷墟中还出土过锡制品。锡的熔点232℃,有两种常见的同素异形体一白锡和灰锡,二者在一定温度下可以相互转化。
①锡的密度为7.28g·cm-3,晶胞参数a=583pmc=318pm,延展性好,质软。通过计算求出一个白锡晶胞中的锡原子数
②灰锡的密度为5.75g·cm-3,有金刚石的结构。灰锡和白锡的部分热力学数据如下:
 /kJ·mol-1 /kJ·mol-1 |  J/-1·K-1·mol-1 J/-1·K-1·mol-1 | |
| Sn(灰) Sn(白) | -2.12 0 | 44.15 51.55 |
通过计算说明常温(25℃)时,灰锡和白锡哪种更稳定
③锡做的茶叶罐不能放在冰箱中冷冻保存,通过计算说明原因
您最近一年使用:0次
解题方法
3 . 磁性材料广泛应用于航空航天高科技领域及电视、电脑、手机等日常生活用品。据报道,苯并[18]冠-6(以X表示,图1)与铯离子可形成一种夹心型的超分子阳离子,它与镍的配合物[Ni(dmit)2]-(以Y表示,图2)结合后可形成复合物并产生独特的晶体结构,具有优越的磁学性能,是铁磁性和反铁磁性共存于同一晶体中的成功范例。

下图是X、Y与Cs+形成的复合物的晶体结构。在此晶体结构图中,a)为沿b轴看晶胞,b)为沿a轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的π-二聚体链。

(1)给出该晶体晶胞的组成,并写出该晶体结构基元的化学式_______ (苯并[18]冠-6用X表示,镍配合物用Y表示)。
(2)指出镍离子的杂化轨道类型:_______ 。如图是平面正方形晶体场d轨道能级分裂图,把基态镍离子的d电子填入该图_______ 。

(3)已知该晶体的晶胞参数a=1278.99pm,b=1305.39pm,c=2717.03pm,α=78.3394°,β=77.0109°,r=70.6358°,试计算该晶体的密度_______ g·cm-3.(相对分子质量:X312.4;Y451.4)
(4)①写出镍配合物Y的对称元素_______ 。
②指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因_______ 。

下图是X、Y与Cs+形成的复合物的晶体结构。在此晶体结构图中,a)为沿b轴看晶胞,b)为沿a轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的π-二聚体链。

(1)给出该晶体晶胞的组成,并写出该晶体结构基元的化学式
(2)指出镍离子的杂化轨道类型:

(3)已知该晶体的晶胞参数a=1278.99pm,b=1305.39pm,c=2717.03pm,α=78.3394°,β=77.0109°,r=70.6358°,试计算该晶体的密度
(4)①写出镍配合物Y的对称元素
②指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因
您最近一年使用:0次
2011高三·全国·竞赛
解题方法
4 . 1965年合成了催化剂A,实现了温和条件下的烯烃加氢。
(1)A是紫红色晶体,分子量925.23,抗磁性。它通过RhCl3·3H2O和过量三苯膦(PPh3)的乙醇溶液回流制得。画出A的立体结构_________ 。
(2)A可能的催化机理如下图所示(图中16e表示中心原子周围总共有16个电子):

画出D的结构式_______ 。
(3)确定图中所有配合物的中心原子的氧化态_________ 。
(4)确定A、C、D和E的中心离子的杂化轨道类型___________ 。
(5)用配合物的价键理论推测C和E显顺磁性还是抗磁性,说明理由__________ 。
(1)A是紫红色晶体,分子量925.23,抗磁性。它通过RhCl3·3H2O和过量三苯膦(PPh3)的乙醇溶液回流制得。画出A的立体结构
(2)A可能的催化机理如下图所示(图中16e表示中心原子周围总共有16个电子):

画出D的结构式
(3)确定图中所有配合物的中心原子的氧化态
(4)确定A、C、D和E的中心离子的杂化轨道类型
(5)用配合物的价键理论推测C和E显顺磁性还是抗磁性,说明理由
您最近一年使用:0次



