名校
1 . 下列实验设计能达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 探究反应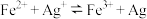 存在限度 存在限度 | 将0.1mol·L-1AgNO3溶液与0.21mol·L-1 溶液等体积混合后,取出两份混合液分别滴加KSCN溶液和 溶液等体积混合后,取出两份混合液分别滴加KSCN溶液和 溶液 溶液 |
| B | 探究浓度对反应速率的影响 | 向两支盛有5mL不同浓度KMnO4溶液的试管中分别加入同浓度同体积的足量草酸溶液,观察实验现象 |
| C | 检验某卤代烃中的是否含有氯元素 | 取卤代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液,观察是否有白色沉淀生成 |
| D | 制备 晶体 晶体 | 向4mL0.1mol·L-1CuSO4溶液中滴加1mol·L-1氨水至沉淀溶解,再加入8mL95%乙醇,过滤 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023·辽宁丹东·一模
解题方法
2 . 下列实验方法不能达到相应实验目的的是
| 选项 | 实验目的 | 实验方法 |
| A | 验证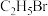 中卤素原子的种类 中卤素原子的种类 | 向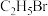 中加入过量的NaOH溶液,加热一段时间后静置,取少量上层清液于试管中,加入 中加入过量的NaOH溶液,加热一段时间后静置,取少量上层清液于试管中,加入 溶液,观察现象 溶液,观察现象 |
| B | 比较 和 和 的热稳定性 的热稳定性 | 分别加热 和 和 固体,将产生的气体通入澄清石灰水,观察现象 固体,将产生的气体通入澄清石灰水,观察现象 |
| C | 验证配位键影响物质的溶解性 | 向NaCl溶液中滴加少量 溶液,产生白色沉淀,继续滴加氨水直至过量,观察现象 溶液,产生白色沉淀,继续滴加氨水直至过量,观察现象 |
| D | 证明某酸 是二元酸 是二元酸 | 用NaOH标准液滴定 溶液,消耗NaOH的物质的量为 溶液,消耗NaOH的物质的量为 的2倍 的2倍 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
3 . 镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
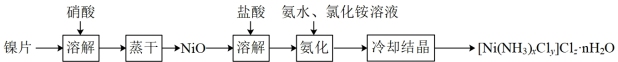
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH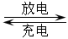 LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是_______ ,写出离子反应方程式:____________________________ 。
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是___________________________________________________________________ 。
(4)氨化过程中应控制溶液pH范围8~9,其原因是_____________________________ 。上述流程中,有关说法正确的是___________
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为______________ 。

(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH
 LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是
(4)氨化过程中应控制溶液pH范围8~9,其原因是
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为
您最近半年使用:0次
名校
解题方法
4 . 实验室以 为原料制备
为原料制备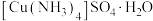 并进行定量分析。
并进行定量分析。
已知:
 。
。
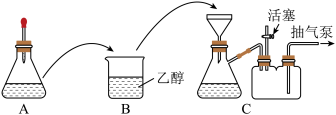
(1)配制溶液。称取一定质量的 晶体,放入锥形瓶中,溶解后滴加氨水,装置如图A所示(胶头滴管中吸有氨水)。
晶体,放入锥形瓶中,溶解后滴加氨水,装置如图A所示(胶头滴管中吸有氨水)。
①与烧杯相比,使用装置A作为反应器的优点是___________ 。
②滴加氨水时,有浅蓝色沉淀 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。写出
溶液。写出 与氨水反应的离子方程式:
与氨水反应的离子方程式:___________ 。
(2)制备晶体。将A中溶液转移至B中,析出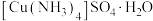 晶体:将B中混合物转移至装置C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,干燥。两次转移均需洗涤原容器,目的是
晶体:将B中混合物转移至装置C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,干燥。两次转移均需洗涤原容器,目的是___________ 。
(3)废液回收。从含有 、乙醇和氨水的废液中回收乙醇并获得
、乙醇和氨水的废液中回收乙醇并获得 、
、 的混合溶液,应加入的试剂是
的混合溶液,应加入的试剂是___________ (填化学式),回收乙醇的实验方法为___________ 。
(4)测定晶体中 的含量。请补充完整实验方案:取一定质量的
的含量。请补充完整实验方案:取一定质量的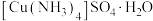 晶体,加适量蒸馏水溶解
晶体,加适量蒸馏水溶解___________ ,干燥,灼烧至恒重。(须使用的试剂:蒸馏水, 溶液,
溶液,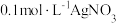 溶液)
溶液)
 为原料制备
为原料制备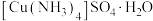 并进行定量分析。
并进行定量分析。已知:

 。
。
(1)配制溶液。称取一定质量的
 晶体,放入锥形瓶中,溶解后滴加氨水,装置如图A所示(胶头滴管中吸有氨水)。
晶体,放入锥形瓶中,溶解后滴加氨水,装置如图A所示(胶头滴管中吸有氨水)。①与烧杯相比,使用装置A作为反应器的优点是
②滴加氨水时,有浅蓝色沉淀
 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。写出
溶液。写出 与氨水反应的离子方程式:
与氨水反应的离子方程式:(2)制备晶体。将A中溶液转移至B中,析出
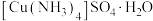 晶体:将B中混合物转移至装置C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,干燥。两次转移均需洗涤原容器,目的是
晶体:将B中混合物转移至装置C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,干燥。两次转移均需洗涤原容器,目的是(3)废液回收。从含有
 、乙醇和氨水的废液中回收乙醇并获得
、乙醇和氨水的废液中回收乙醇并获得 、
、 的混合溶液,应加入的试剂是
的混合溶液,应加入的试剂是(4)测定晶体中
 的含量。请补充完整实验方案:取一定质量的
的含量。请补充完整实验方案:取一定质量的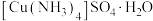 晶体,加适量蒸馏水溶解
晶体,加适量蒸馏水溶解 溶液,
溶液,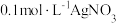 溶液)
溶液)
您最近半年使用:0次
5 . 钴及其化合物在工业生产中有着广阔的应用前景。已知: 不易被氧化,
不易被氧化, 具有强氧化性,
具有强氧化性, 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。
(1)从锂钴废料(主要成分为 )分离
)分离 。
。
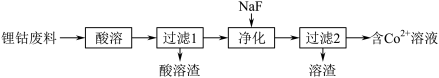
① 的电子排布式为
的电子排布式为_______ 。
②“酸溶”时不选择浓 的理由是:
的理由是:_______ 。
③“净化”时,加 固体是将
固体是将 转化为沉淀,“净化”后溶液中
转化为沉淀,“净化”后溶液中 ,若“过滤1”后溶液中
,若“过滤1”后溶液中 浓度为1.0
浓度为1.0 ,则“净化”后
,则“净化”后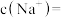
_______ 。[溶液体积变化忽略不计,不考虑其他离子影响。25℃时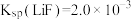 ]
]
(2)从由 制备
制备 。
。
实验过程:称取研细的 10.0g和
10.0g和 50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25
50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25 浓氨水,5
浓氨水,5 30%的
30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液,实验装置如图所示:
溶液,实验装置如图所示:
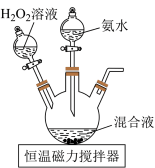
①由 制备
制备 溶液的离子方程式为
溶液的离子方程式为_______ 。
②分液漏斗中液体加入三颈烧瓶中的顺序为_______ 。
(3) 热分解制备
热分解制备 。
。
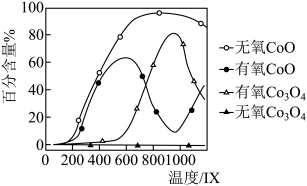
有氧和无氧环境下, 热解所得
热解所得 和
和 的百分含量与温度关系如图所示,请补充完整由
的百分含量与温度关系如图所示,请补充完整由 制备较纯净的
制备较纯净的 实验方案,取一定质量的
实验方案,取一定质量的 于热解装置中,
于热解装置中,_______ ,干燥。 (已知: 、
、 均难溶于水,
均难溶于水, 难溶于酸,
难溶于酸, 能溶于酸中,须使用的试剂有:1
能溶于酸中,须使用的试剂有:1
 ,蒸馏水,
,蒸馏水, 溶液)
溶液)
 不易被氧化,
不易被氧化, 具有强氧化性,
具有强氧化性, 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。(1)从锂钴废料(主要成分为
 )分离
)分离 。
。
①
 的电子排布式为
的电子排布式为②“酸溶”时不选择浓
 的理由是:
的理由是:③“净化”时,加
 固体是将
固体是将 转化为沉淀,“净化”后溶液中
转化为沉淀,“净化”后溶液中 ,若“过滤1”后溶液中
,若“过滤1”后溶液中 浓度为1.0
浓度为1.0 ,则“净化”后
,则“净化”后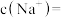
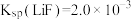 ]
](2)从由
 制备
制备 。
。实验过程:称取研细的
 10.0g和
10.0g和 50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25
50g于烧杯中溶解,将溶液转入三颈烧瓶,分液漏斗中分别装有25 浓氨水,5
浓氨水,5 30%的
30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液,实验装置如图所示:
溶液,实验装置如图所示:
①由
 制备
制备 溶液的离子方程式为
溶液的离子方程式为②分液漏斗中液体加入三颈烧瓶中的顺序为
(3)
 热分解制备
热分解制备 。
。有氧和无氧环境下,
 热解所得
热解所得 和
和 的百分含量与温度关系如图所示,请补充完整由
的百分含量与温度关系如图所示,请补充完整由 制备较纯净的
制备较纯净的 实验方案,取一定质量的
实验方案,取一定质量的 于热解装置中,
于热解装置中, 、
、 均难溶于水,
均难溶于水, 难溶于酸,
难溶于酸, 能溶于酸中,须使用的试剂有:1
能溶于酸中,须使用的试剂有:1
 ,蒸馏水,
,蒸馏水, 溶液)
溶液)
您最近半年使用:0次
2023-09-02更新
|
209次组卷
|
3卷引用:江苏省镇江市丹阳市2023-2024学年高三上学期开学考试化学试题
名校
6 . 无水氯化钴( )呈蓝色,吸收不同量的水后变为粉红色至红色(如
)呈蓝色,吸收不同量的水后变为粉红色至红色(如 呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、
呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、 ,含少量Ni、
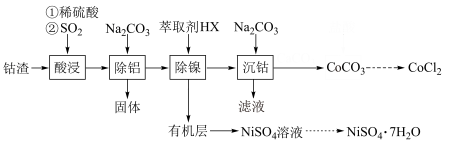
,含少量Ni、 等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
②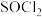 极易水解生成两种气体,其中一种气体能使品红溶液褪色。
极易水解生成两种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
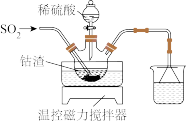
(1)酸浸。将一定量钴渣加入到三颈瓶中(装置如图所示),将稀硫酸通过滴液漏斗加入其中,再向悬浊液中通入 。写出
。写出 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(2)除铝。得到固体的主要成分是_______ (填化学式),该步调节pH的范围为_______ 。
(3)制备无水 。实验室由
。实验室由 制备无水
制备无水 ,请补充实验方案:①
,请补充实验方案:①_______ ,用蒸馏水洗涤2~3次,低温干燥。将所得固体( )置于圆底烧瓶中,②
)置于圆底烧瓶中,②_______ ,停止加热,得到无水 。(实验中须使用的试剂:
。(实验中须使用的试剂: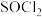 、
、 盐酸、
盐酸、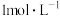 NaOH溶液)。
NaOH溶液)。
(4)钴(Ⅲ)可形成 (
(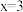 ,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L
,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L  溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为
溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为_______ (写出计算过程)。
 )呈蓝色,吸收不同量的水后变为粉红色至红色(如
)呈蓝色,吸收不同量的水后变为粉红色至红色(如 呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、
呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、 ,含少量Ni、
,含少量Ni、 等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
| 金属离子 |  |  |  |
| 升始沉淀的pH | 4.0 | 7.6 | 7.7 |
| 完全沉淀的pH | 5.2 | 9.2 | 9.5 |
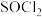 极易水解生成两种气体,其中一种气体能使品红溶液褪色。
极易水解生成两种气体,其中一种气体能使品红溶液褪色。回答下列问题:
(1)酸浸。将一定量钴渣加入到三颈瓶中(装置如图所示),将稀硫酸通过滴液漏斗加入其中,再向悬浊液中通入
 。写出
。写出 参与反应的离子方程式为
参与反应的离子方程式为
(2)除铝。得到固体的主要成分是
(3)制备无水
 。实验室由
。实验室由 制备无水
制备无水 ,请补充实验方案:①
,请补充实验方案:① )置于圆底烧瓶中,②
)置于圆底烧瓶中,② 。(实验中须使用的试剂:
。(实验中须使用的试剂: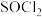 、
、 盐酸、
盐酸、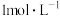 NaOH溶液)。
NaOH溶液)。(4)钴(Ⅲ)可形成
 (
(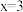 ,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L
,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L  溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为
溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为
您最近半年使用:0次
2022-06-07更新
|
495次组卷
|
2卷引用:江苏省南京外国语学校、海安中学、金陵中学三校2021-2022学年高三下学期5月联考化学试题



