名校
1 . 下列实验设计能达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 探究反应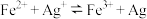 存在限度 存在限度 | 将0.1mol·L-1AgNO3溶液与0.21mol·L-1 溶液等体积混合后,取出两份混合液分别滴加KSCN溶液和 溶液等体积混合后,取出两份混合液分别滴加KSCN溶液和 溶液 溶液 |
| B | 探究浓度对反应速率的影响 | 向两支盛有5mL不同浓度KMnO4溶液的试管中分别加入同浓度同体积的足量草酸溶液,观察实验现象 |
| C | 检验某卤代烃中的是否含有氯元素 | 取卤代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液,观察是否有白色沉淀生成 |
| D | 制备 晶体 晶体 | 向4mL0.1mol·L-1CuSO4溶液中滴加1mol·L-1氨水至沉淀溶解,再加入8mL95%乙醇,过滤 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 . 铁氰化钾 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。
实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。
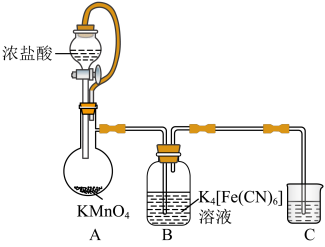
(1)装置A中橡胶管的作用是___________ 。装置C中试剂可能是___________ 。
(2)装置B中化学方程式为___________ 。
(3)从装置B中分离产品,可采用___________ 、降温结晶、___________ 、洗涤、干燥一系列操作。
实验(二)探究 性质。
性质。
【资料显示】
配合物在水中能完全电离出外界和内界,例如: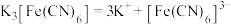 。
。
【提出问题】
 能否电离?
能否电离?
【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
(4)猜想3的横线上应填___________ ,综合上述实验分析,可知:猜想___________ 成立。
(5)用方程式和必要的文字分析实验②现象:___________ ,写出产生蓝色沉淀的离子方程式:___________ 。
 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。

(1)装置A中橡胶管的作用是
(2)装置B中化学方程式为
(3)从装置B中分离产品,可采用
实验(二)探究
 性质。
性质。【资料显示】
配合物在水中能完全电离出外界和内界,例如:
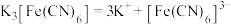 。
。【提出问题】
 能否电离?
能否电离?【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
| 实验 | 实验操作及现象 |
| ① | 向浓度均为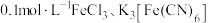 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 |
| ② | 向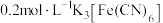 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 |
(4)猜想3的横线上应填
(5)用方程式和必要的文字分析实验②现象:
您最近半年使用:0次
3 . 化学是一门以实验为基础的学科。回答下列问题:
I.碘的溶解性
(1)在碘水溶液中加入1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,形成___________ 色的碘的四氯化碳溶液。再向试管里加入1mL浓碘化钾水溶液,振荡试管,溶液颜色变浅,用离子方程式解释溶液颜色变浅的原因:___________ ,碘在四氯化碳中比在纯水中的溶解性好,试从分子结构角度解释其原因:___________ 。
Ⅱ. 晶体制备
晶体制备
(2)向盛有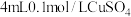 溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为
溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为___________ 。再向试管中加入极性较___________ 的试剂乙醇(填“大”或“小”),并用玻璃棒摩擦试管壁,可以观察到有___________ 色的Cu(NH3)4SO4·H2O晶体析出。
Ⅲ.乙酸乙酯的制备
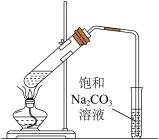
(3)利用下图装置制备乙酸乙酯,乙醇、乙酸、浓硫酸三种试剂的加入顺序为___________ ,反应的化学方程式为___________ 。
I.碘的溶解性
(1)在碘水溶液中加入1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,形成
Ⅱ.
 晶体制备
晶体制备(2)向盛有
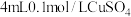 溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为
溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为Ⅲ.乙酸乙酯的制备
(3)利用下图装置制备乙酸乙酯,乙醇、乙酸、浓硫酸三种试剂的加入顺序为

您最近半年使用:0次
4 .  是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与
溶液与 的反应。
的反应。
已知: 晶体易升华,
晶体易升华, 易水解。
易水解。
Ⅰ. 的制备
的制备
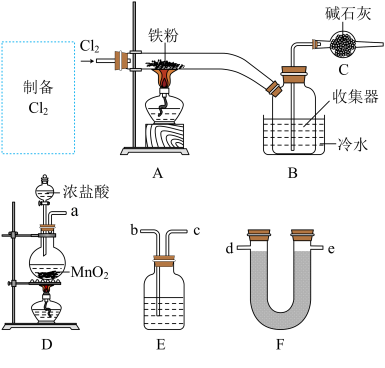
(1)装置C中碱石灰的作用是_____ 。
(2)从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a→
,正确的接口顺序为a→_____ (可选试剂:饱和食盐水、 溶液、浓硫酸、碱石灰,仪器可以重复使用)。
溶液、浓硫酸、碱石灰,仪器可以重复使用)。
(3)写出装置D中制备 的离子方程式:
的离子方程式:_____ 。
Ⅱ.探究 溶液与
溶液与 的反应
的反应
向 溶液中滴加几滴
溶液中滴加几滴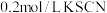 溶液,溶液变红;再加入过量
溶液,溶液变红;再加入过量 粉,溶液红色褪去,不久有白色沉淀产生。
粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的
与过量的 粉反应生成
粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想_____ (填“1”或“2”)不合理。
(5)根据实验现象进一步查阅资料发现:
i. 与
与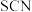 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色)
(淡黄色)
反应B: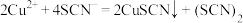 (黄色)。
(黄色)。
ii.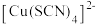 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A_____ (填“>”或“<”)B,说明反应B_____ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在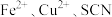 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入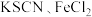 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式:
,写出该反应离子方程式:_____ 。
 是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与
溶液与 的反应。
的反应。已知:
 晶体易升华,
晶体易升华, 易水解。
易水解。Ⅰ.
 的制备
的制备
(1)装置C中碱石灰的作用是
(2)从D、E、F中选择合适的装置制备纯净的
 ,正确的接口顺序为a→
,正确的接口顺序为a→ 溶液、浓硫酸、碱石灰,仪器可以重复使用)。
溶液、浓硫酸、碱石灰,仪器可以重复使用)。(3)写出装置D中制备
 的离子方程式:
的离子方程式:Ⅱ.探究
 溶液与
溶液与 的反应
的反应向
 溶液中滴加几滴
溶液中滴加几滴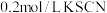 溶液,溶液变红;再加入过量
溶液,溶液变红;再加入过量 粉,溶液红色褪去,不久有白色沉淀产生。
粉,溶液红色褪去,不久有白色沉淀产生。查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的
与过量的 粉反应生成
粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |  | 加入铜粉后无现象 |
| 实验2 |  | 溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验现象进一步查阅资料发现:
i.
 与
与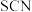 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色)
(淡黄色)反应B:
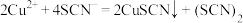 (黄色)。
(黄色)。ii.
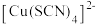 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
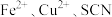 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入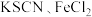 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式:
,写出该反应离子方程式:
您最近半年使用:0次
5 .  是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与Cu的反应。
溶液与Cu的反应。
已知: 晶体易升华,
晶体易升华, 溶液易水解。
溶液易水解。
Ⅰ. 的制备
的制备

(1)装置C中碱石灰的作用是_______ 。
(2)从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为
,正确的接口顺序为
_______ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的化学方程式:
的化学方程式:_______ 。
Ⅱ.探究 溶液与Cu的反应
溶液与Cu的反应
向4mL 溶液中滴加几滴
溶液中滴加几滴 KSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
KSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:CuCl和CuSCN均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀CuCl。
生成白色沉淀CuCl。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀CuSCN。
生成白色沉淀CuSCN。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想_______ (填“1”或“2”)不合理。
(5)根据实验现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡荧色)
(淡荧色)
反应B: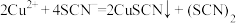 (黄色)。
(黄色)。
ii.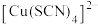 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A_______ (填“>”或“<”)B,说明反应B_______ (填“是”或“不是”)产生CuSCN的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入KSCN、
溶液中同时加入KSCN、 ,立即生成白色沉淀CuSCN,写出该反应离子方程式:
,立即生成白色沉淀CuSCN,写出该反应离子方程式:_______ 。
(6)若向100mL 溶液中滴加足量的KSCN和
溶液中滴加足量的KSCN和 的混合溶液,经过一系列操作得到白色沉淀CuSCN的质表bg,则CuSCN的产率为
的混合溶液,经过一系列操作得到白色沉淀CuSCN的质表bg,则CuSCN的产率为_______ 。
 是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与Cu的反应。
溶液与Cu的反应。已知:
 晶体易升华,
晶体易升华, 溶液易水解。
溶液易水解。Ⅰ.
 的制备
的制备
(1)装置C中碱石灰的作用是
(2)从D、E、F中选择合适的装置制备纯净的
 ,正确的接口顺序为
,正确的接口顺序为
(3)写出装置D中制备
 的化学方程式:
的化学方程式:Ⅱ.探究
 溶液与Cu的反应
溶液与Cu的反应向4mL
 溶液中滴加几滴
溶液中滴加几滴 KSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
KSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。查阅资料可知:CuCl和CuSCN均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀CuCl。
生成白色沉淀CuCl。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀CuSCN。
生成白色沉淀CuSCN。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 | 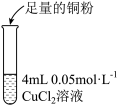 | 加入铜粉后无现象 |
| 实验2 | 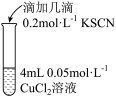 | 溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡荧色)
(淡荧色)反应B:
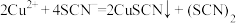 (黄色)。
(黄色)。ii.
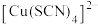 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入KSCN、
溶液中同时加入KSCN、 ,立即生成白色沉淀CuSCN,写出该反应离子方程式:
,立即生成白色沉淀CuSCN,写出该反应离子方程式:(6)若向100mL
 溶液中滴加足量的KSCN和
溶液中滴加足量的KSCN和 的混合溶液,经过一系列操作得到白色沉淀CuSCN的质表bg,则CuSCN的产率为
的混合溶液,经过一系列操作得到白色沉淀CuSCN的质表bg,则CuSCN的产率为
您最近半年使用:0次
名校
6 . 某小组拟用自制的氨水制取银氨溶液,并探究银氨溶液的性质。回答下列问题:
(一)氨水的制备:制备装置如图,
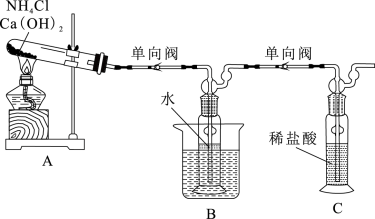
(1)A中反应的化学方程式为:_______ 。
(2)使用加装单向阀的导管,目的是_______ ;为有利于制备氨水,装置B的大烧杯中应盛装_______ (填“热水”或“冰水”),氨气溶于水时放热或吸热的主要原因是_______ 。
(二)探究银氨溶液的制备(实验中所用氨水均为新制)
已知:白色AgOH沉淀不稳定,极易分解生成棕褐色Ag2O;Ag2O溶于浓氨水生成[Ag(NH3)2]+。
(3)实验I中沉淀消失的化学方程式为_______ 。
(4)实验测得Ⅱ中所用的氨水比I中所用氨水的pH小,可能原因有_______ 。
(三)该实验小组同学设计如下实验:
实验1:向2mL银氨溶液中滴加5滴10%NaOH溶液,立即产生棕黑色浑浊;置于沸水浴中加热,有气体产生;一段时间后溶液逐渐变黑,最终试管壁附着光亮银镜。
实验2:向2mL银氨溶液中滴加5滴10%氨水,置于沸水浴中加热,有气体产生;一段时间后溶液无明显变化。
(5)经检验,实验I产生的气体能使湿润的红色石蕊试纸变蓝,黑色物质中有Ag2O,写出沸水浴时发生反应的离子方程式:_______ 。
(6)该实验小组同学设计上述实验的目的是_______ 。
(一)氨水的制备:制备装置如图,

(1)A中反应的化学方程式为:
(2)使用加装单向阀的导管,目的是
(二)探究银氨溶液的制备(实验中所用氨水均为新制)
| 实验装置 | 实验序号 | 实验操作 | 实验现象 |
 1mL2%AgNO3溶液 | I | 向试管中滴加2%氨水1mL并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
| Ⅱ | 向试管中滴加2%氨水(经敞口放置空气中48小时)1mL | 产生白色略暗沉淀 |
(3)实验I中沉淀消失的化学方程式为
(4)实验测得Ⅱ中所用的氨水比I中所用氨水的pH小,可能原因有
(三)该实验小组同学设计如下实验:
实验1:向2mL银氨溶液中滴加5滴10%NaOH溶液,立即产生棕黑色浑浊;置于沸水浴中加热,有气体产生;一段时间后溶液逐渐变黑,最终试管壁附着光亮银镜。
实验2:向2mL银氨溶液中滴加5滴10%氨水,置于沸水浴中加热,有气体产生;一段时间后溶液无明显变化。
(5)经检验,实验I产生的气体能使湿润的红色石蕊试纸变蓝,黑色物质中有Ag2O,写出沸水浴时发生反应的离子方程式:
(6)该实验小组同学设计上述实验的目的是
您最近半年使用:0次
2022-04-24更新
|
328次组卷
|
2卷引用:福建省龙岩第一中学2022届高三毕业班模拟训练(二)化学试题
7 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐[(NH4)2Fe(SO4)2·6H2O]制备K3[Fe(C2O4)3]·3H2O的流程如图所示。

回答下列问题:
(1)K3[Fe(C2O4)3]中铁离子的配位数为___ ,其配体C2O 中C原子的杂化方式为
中C原子的杂化方式为___ 。
(2)步骤②发生反应的化学方程式为___ 。
(3)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量___ (已知:常温下KHC2O4溶液的pH约为3.5)。
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是___ 。
(5)某研究小组将K3[Fe(C2O4)3]·3H2O在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有CO和CO2。

①按气流从左到右的方向,依次连接的合理顺序为___ (填装置序号)。
②确认气体产物中含CO的现象为___ 。
(6)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,[Ni(NH3)6]SO4中配体的构型是___ ,阴离子的立体构型是___ 。

回答下列问题:
(1)K3[Fe(C2O4)3]中铁离子的配位数为
 中C原子的杂化方式为
中C原子的杂化方式为(2)步骤②发生反应的化学方程式为
(3)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是
(5)某研究小组将K3[Fe(C2O4)3]·3H2O在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有CO和CO2。

①按气流从左到右的方向,依次连接的合理顺序为
②确认气体产物中含CO的现象为
(6)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,[Ni(NH3)6]SO4中配体的构型是
您最近半年使用:0次
解题方法
8 .  (三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐
(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐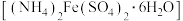 制备
制备 的流程如图所示。
的流程如图所示。

回答下列问题:
(1) 中铁离子的配位数为
中铁离子的配位数为__________ ,其配体 中C原子的杂化方式为
中C原子的杂化方式为________ 。
(2)步骤②发生反应的化学方程式为__________________________________________________ 。
(3)步骤③将 加入到
加入到 溶液中,水浴加热,控制溶液pH为
溶液中,水浴加热,控制溶液pH为 ,随反应进行需加入适量
,随反应进行需加入适量__________ (已知:常温下 溶液的pH约为3.5)。
溶液的pH约为3.5)。
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是____________________ 。
(5)某研究小组将 在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和
在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和 。
。

①按气流从左到右的方向,依次连接的合理顺序为_________________ (填装置序号)。
②确认气体产物中含CO的现象为____________________ 。
 (三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐
(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐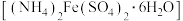 制备
制备 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)
 中铁离子的配位数为
中铁离子的配位数为 中C原子的杂化方式为
中C原子的杂化方式为(2)步骤②发生反应的化学方程式为
(3)步骤③将
 加入到
加入到 溶液中,水浴加热,控制溶液pH为
溶液中,水浴加热,控制溶液pH为 ,随反应进行需加入适量
,随反应进行需加入适量 溶液的pH约为3.5)。
溶液的pH约为3.5)。(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是
(5)某研究小组将
 在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和
在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和 。
。
①按气流从左到右的方向,依次连接的合理顺序为
②确认气体产物中含CO的现象为
您最近半年使用:0次
2020-11-24更新
|
589次组卷
|
4卷引用:山东省临沂市2021届高三上学期期中考试化学试题
9 . 下列实验目的及现象、结论都正确的是
| 选项 | 实验目的及现象 | 结论 |
| A | 向盛有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续添加氨水,沉淀溶解得到溶液A;继续加乙醇,析出晶体B,A、B都显深蓝色 | A、B中含有相同的配离子 |
| B | 向紫色石蕊试液中加入过量的Na2O2,溶液变蓝,且不褪色 | Na2O2溶于水生成碱性物质 |
| C | 室温下,用pH计测定0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH,测得前者pH大 | HClO的酸性比CH3COOH的酸性强 |
| D | 向盛有CH3CH2Br中的试管中加入NaOH的乙醇溶液,然后加热,产生的气体通入盛有酸性KMnO4溶液的试管中,KMnO4溶液紫色褪去 | CH3CH2Br发生消去反应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
10 . 下列实验设计、现象和结论都正确的是
| 选项 | 实验目的 | 实验设计 | 现象和结论 |
| A | 探究温度对化学平衡的影响 | 加热0.5mol•L-1CuCl2蓝色溶液 | 加热溶液变为蓝绿色,说明[Cu(H2O)4]2+转化为[CuCl4]2-吸热 |
| B | 比较AgBr和AgCl的Ksp大小 | 向NaCl和NaBr的混合溶液中逐滴加入少量AgNO3溶液 | 产生淡黄色沉淀,说明Ksp(AgBr)<Ksp(AgCl) |
| C | 证明干燥的氯气不具有漂白性 | 将干燥的氯气通入盛放红色鲜花的集气瓶中 | 红色鲜花颜色褪去,说明干燥的氯气有漂白性 |
| D | 探究浓度对反应速率的影响 | 室温下向A、B两支试管中分别装入等体积的稀硫酸和浓硫酸,再加入表面积相等的铁片 | B试管中无明显现象,说明浓度越大反应速率越慢 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



