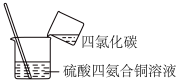
1 . 化学是一门以实验为基础的学科。回答下列问题:
I.碘的溶解性
(1)在碘水溶液中加入1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,形成___________ 色的碘的四氯化碳溶液。再向试管里加入1mL浓碘化钾水溶液,振荡试管,溶液颜色变浅,用离子方程式解释溶液颜色变浅的原因:___________ ,碘在四氯化碳中比在纯水中的溶解性好,试从分子结构角度解释其原因:___________ 。
Ⅱ. 晶体制备
晶体制备
(2)向盛有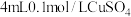 溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为
溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为___________ 。再向试管中加入极性较___________ 的试剂乙醇(填“大”或“小”),并用玻璃棒摩擦试管壁,可以观察到有___________ 色的Cu(NH3)4SO4·H2O晶体析出。
Ⅲ.乙酸乙酯的制备
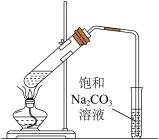
(3)利用下图装置制备乙酸乙酯,乙醇、乙酸、浓硫酸三种试剂的加入顺序为___________ ,反应的化学方程式为___________ 。
I.碘的溶解性
(1)在碘水溶液中加入1mL四氯化碳,振荡试管,观察碘被四氯化碳萃取,形成
Ⅱ.
 晶体制备
晶体制备(2)向盛有
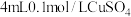 溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为
溶液的试管里滴加几滴1molL氨水,首先形成难溶物,继续添加氨水并振荡试管,可以观察到的实验现象为Ⅲ.乙酸乙酯的制备
(3)利用下图装置制备乙酸乙酯,乙醇、乙酸、浓硫酸三种试剂的加入顺序为

您最近半年使用:0次
2 .  是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与
溶液与 的反应。
的反应。
已知: 晶体易升华,
晶体易升华, 易水解。
易水解。
Ⅰ. 的制备
的制备
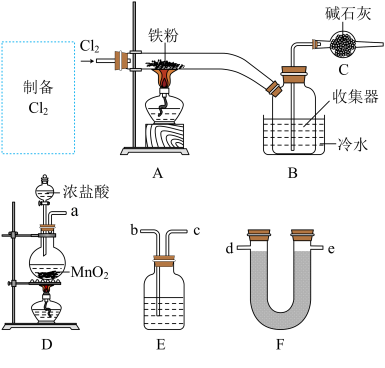
(1)装置C中碱石灰的作用是_____ 。
(2)从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a→
,正确的接口顺序为a→_____ (可选试剂:饱和食盐水、 溶液、浓硫酸、碱石灰,仪器可以重复使用)。
溶液、浓硫酸、碱石灰,仪器可以重复使用)。
(3)写出装置D中制备 的离子方程式:
的离子方程式:_____ 。
Ⅱ.探究 溶液与
溶液与 的反应
的反应
向 溶液中滴加几滴
溶液中滴加几滴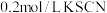 溶液,溶液变红;再加入过量
溶液,溶液变红;再加入过量 粉,溶液红色褪去,不久有白色沉淀产生。
粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的
与过量的 粉反应生成
粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想_____ (填“1”或“2”)不合理。
(5)根据实验现象进一步查阅资料发现:
i. 与
与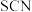 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色)
(淡黄色)
反应B: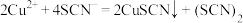 (黄色)。
(黄色)。
ii.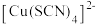 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A_____ (填“>”或“<”)B,说明反应B_____ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在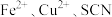 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入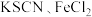 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式:
,写出该反应离子方程式:_____ 。
 是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与
溶液与 的反应。
的反应。已知:
 晶体易升华,
晶体易升华, 易水解。
易水解。Ⅰ.
 的制备
的制备
(1)装置C中碱石灰的作用是
(2)从D、E、F中选择合适的装置制备纯净的
 ,正确的接口顺序为a→
,正确的接口顺序为a→ 溶液、浓硫酸、碱石灰,仪器可以重复使用)。
溶液、浓硫酸、碱石灰,仪器可以重复使用)。(3)写出装置D中制备
 的离子方程式:
的离子方程式:Ⅱ.探究
 溶液与
溶液与 的反应
的反应向
 溶液中滴加几滴
溶液中滴加几滴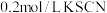 溶液,溶液变红;再加入过量
溶液,溶液变红;再加入过量 粉,溶液红色褪去,不久有白色沉淀产生。
粉,溶液红色褪去,不久有白色沉淀产生。查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的
与过量的 粉反应生成
粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |  | 加入铜粉后无现象 |
| 实验2 |  | 溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验现象进一步查阅资料发现:
i.
 与
与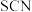 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色)
(淡黄色)反应B:
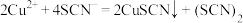 (黄色)。
(黄色)。ii.
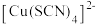 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
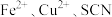 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入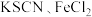 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式:
,写出该反应离子方程式:
您最近半年使用:0次
解题方法
3 .  (三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐
(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐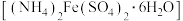 制备
制备 的流程如图所示。
的流程如图所示。

回答下列问题:
(1) 中铁离子的配位数为
中铁离子的配位数为__________ ,其配体 中C原子的杂化方式为
中C原子的杂化方式为________ 。
(2)步骤②发生反应的化学方程式为__________________________________________________ 。
(3)步骤③将 加入到
加入到 溶液中,水浴加热,控制溶液pH为
溶液中,水浴加热,控制溶液pH为 ,随反应进行需加入适量
,随反应进行需加入适量__________ (已知:常温下 溶液的pH约为3.5)。
溶液的pH约为3.5)。
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是____________________ 。
(5)某研究小组将 在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和
在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和 。
。

①按气流从左到右的方向,依次连接的合理顺序为_________________ (填装置序号)。
②确认气体产物中含CO的现象为____________________ 。
 (三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐
(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐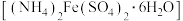 制备
制备 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)
 中铁离子的配位数为
中铁离子的配位数为 中C原子的杂化方式为
中C原子的杂化方式为(2)步骤②发生反应的化学方程式为
(3)步骤③将
 加入到
加入到 溶液中,水浴加热,控制溶液pH为
溶液中,水浴加热,控制溶液pH为 ,随反应进行需加入适量
,随反应进行需加入适量 溶液的pH约为3.5)。
溶液的pH约为3.5)。(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是
(5)某研究小组将
 在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和
在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和 。
。
①按气流从左到右的方向,依次连接的合理顺序为
②确认气体产物中含CO的现象为
您最近半年使用:0次
2020-11-24更新
|
590次组卷
|
4卷引用:山东省临沂市2021届高三上学期期末教学质量检测考试化学试题
名校
解题方法
4 . 下列实验不能达到实验目的的是
A | B | C | D |
|
|
|
|
加热融化硫固体 | 减缓水体中钢铁设施的腐蚀 | 制备硫酸四氨合铜晶体 | 制备明矾晶体 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
5 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子有_______ 个未成对电子。
(2)光催化还原CO2制备CH4的反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(3)单晶Ge具有金刚石型结构,微粒之间存在的作用力是_______ 。
(4)与Ge同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_______ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为_______ 。
(1)基态Ge原子有
(2)光催化还原CO2制备CH4的反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
(3)单晶Ge具有金刚石型结构,微粒之间存在的作用力是
(4)与Ge同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是
您最近半年使用:0次
6 . 硫酸四氨合铜晶体( )常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备
)常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备 的流程如下:
的流程如下:
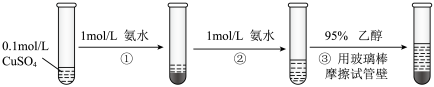
请回答:
(1)写出过程②发生反应的离子方程式_______ 。
(2)过程③加入95%乙醇的作用是_______ 。
(3)根据①→②→③的现象,给出相应微粒与 结合由弱到强的排序
结合由弱到强的排序_______ 。
(4) 具有对称的空间构型,若其中两个
具有对称的空间构型,若其中两个 被两个
被两个 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为_______ 。
(5)下列说法正确的是_______。
 )常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备
)常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。实验室制备 的流程如下:
的流程如下:
请回答:
(1)写出过程②发生反应的离子方程式
(2)过程③加入95%乙醇的作用是
(3)根据①→②→③的现象,给出相应微粒与
 结合由弱到强的排序
结合由弱到强的排序(4)
 具有对称的空间构型,若其中两个
具有对称的空间构型,若其中两个 被两个
被两个 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则 的空间构型为
的空间构型为(5)下列说法正确的是_______。
A.③中发生反应的离子方程式为: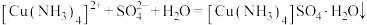 |
| B.③中用玻璃棒摩擦器壁可以促进晶体析出 |
C. 晶体中存在共价键、配位键、离子键和氢键 晶体中存在共价键、配位键、离子键和氢键 |
D.硫酸四氨合铜晶体在水中的电离方程式为: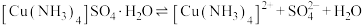 |
您最近半年使用:0次
名校
7 . 电镀实验在生产生活中应用广泛。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是___________ (填阴极或阳极),对应的电极方程式为:___________ ;如图装置电解一段时间后,溶液中___________ (填微粒化学式)浓度下降,从而影响镀铜的速率和质量。
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)实验①中,无色气体产生的原因是 或
或___________ 。
(3)实验①中,气体减少,推测是由于溶液中 减少,且
减少,且___________ 。
(4)欲测定实验①溶液中 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的___________ ,用 标准溶液滴定时应选用
标准溶液滴定时应选用___________ 滴定管(填“酸式”或“碱式”)。
(5)为确定实验①电解质溶液中 的准确浓度
的准确浓度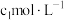 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用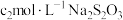 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: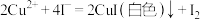 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为___________ ,滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液___________ 。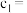
___________ (用 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果___________ (填“偏大”“偏小”或“无影响”)。
(6)实验②中, 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为___________ ,反应后的体系呈___________ 色。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
| 装置示意图 | 序号 | 电解质溶液 | 实验现象 |
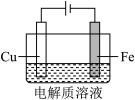 | ① | 0.1mol/L +少量 +少量 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有 生成。 生成。 |
| ② | 0.1mol/L +过量氨水 +过量氨水 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。 |
 或
或(3)实验①中,气体减少,推测是由于溶液中
 减少,且
减少,且(4)欲测定实验①溶液中
 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的 标准溶液滴定时应选用
标准溶液滴定时应选用(5)为确定实验①电解质溶液中
 的准确浓度
的准确浓度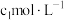 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用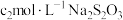 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: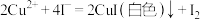 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为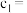
 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(6)实验②中,
 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为
您最近半年使用:0次
2023-07-13更新
|
123次组卷
|
2卷引用:广东省四校(华附,省实,广雅,深中)2022-2023学年高二下学期期末联考化学试题
8 . [Co(en)2Cl2]Cl配合物存在顺反异构现象。制备trans-[Co(en)2Cl2]Cl的实验过程如下。

乙二胺缩写为en,实验过程含钴离子依次发生如下变化:[Co(H2O)6]2+→[Co(en)2(H2O)2]2+→[Co(en)2(H2O)2]3+→[Co(en)2C12]+
(1)“溶解”过程Co(II)的配位数_______ 变化(填“发生”或“未发生”)。
(2)“氧化”过程Co(II)转化为Co(III)的离子方程式为_______ 。
(3)“氯化”过程使用浓盐酸而不用NaCl。浓盐酸的作用有_______ 。
(4)“蒸发浓缩”至_______ 停止加热。
(5)trans-[Co(en)2Cl2]Cl转化为cis-[Co(en)2Cl2]Cl的实验如下。

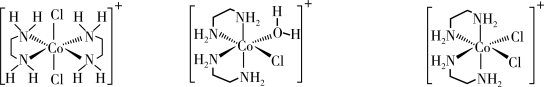
①由上述实验可知;生成trans-[Co(en)2Cl2]Cl是_______ 决速(填“热力学”或“动力学”,下同),生成cis-[Co(en)2Cl2]Cl是_______ 决速。
②设计实验将cis-[Co(en)2Cl2]Cl转化为trans-[Co(en)2Cl2]Cl_______ 。

乙二胺缩写为en,实验过程含钴离子依次发生如下变化:[Co(H2O)6]2+→[Co(en)2(H2O)2]2+→[Co(en)2(H2O)2]3+→[Co(en)2C12]+
(1)“溶解”过程Co(II)的配位数
(2)“氧化”过程Co(II)转化为Co(III)的离子方程式为
(3)“氯化”过程使用浓盐酸而不用NaCl。浓盐酸的作用有
(4)“蒸发浓缩”至
(5)trans-[Co(en)2Cl2]Cl转化为cis-[Co(en)2Cl2]Cl的实验如下。


①由上述实验可知;生成trans-[Co(en)2Cl2]Cl是
②设计实验将cis-[Co(en)2Cl2]Cl转化为trans-[Co(en)2Cl2]Cl
您最近半年使用:0次
名校
9 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象与结论 | |
| A | 验证压强对化学平衡的影响 | 先将注射器充满NO2气体,然后将活塞往里推压缩体积 | 观察到注射器内气体颜色加深,证明加压平衡朝生成NO2气体的方向移动 |
| B | 铜的电解精炼 | 待精炼的铜和纯铜连接外加直流电源的阳极和阴极,用硫酸铜溶液作电解质电解 | 阳极上铜逐渐溶解,阴极上铜逐渐析出,硫酸铜溶液浓度保持不变 |
| C | 制备[Cu(NH3)4]SO4·H2O晶体 | 向4mL 0.1mol/LCuSO4溶液中滴加氨水,先形成难溶物,并继续滴加沉淀溶解,然后蒸发溶剂析出晶体 | 反应过程中,NH3的N给出孤对电子,Cu2+接受电子对,形成了稳定的配位键[Cu(NH3)4]2+ |
| D | 除去锅炉水垢中的CaSO4 | 先用碳酸钠溶液浸泡水垢,然后再用盐酸除去 | 利用Ksp(CaSO4)> Ksp(CaCO3),实现沉淀的转化 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-01-21更新
|
404次组卷
|
4卷引用:浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题
浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题(已下线)3.4 配合物与超分子-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)浙江省富阳区第二中学2021-2022学年高二下学期(3月)检测化学试题 河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题
10 . 乙二胺四乙酸 简称EDTA,白色粉末,微溶于冷水,是一种重要的络合剂。实验室常用氯乙酸
简称EDTA,白色粉末,微溶于冷水,是一种重要的络合剂。实验室常用氯乙酸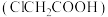 、乙二胺
、乙二胺 、NaOH为原料制备EDTA,操作步骤及反应装置如下(夹持装置略):
、NaOH为原料制备EDTA,操作步骤及反应装置如下(夹持装置略):

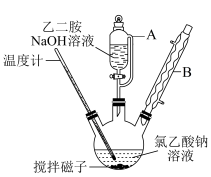
回答下列问题:
(1)制备氯乙酸钠时,能否用 替代
替代
_______ (填“能”或“否”)?理由是_______ 。
(2)仪器A的名称是_______ ;仪器B的作用是_______ 。
(3)制备乙二胺四乙酸四钠宜采用的加热方式为_______ ,该反应的化学方程式为_______ 。
(4)EDTA的产率为_______ (EDTA的相对分子质量为292)。
(5)EDTA可与多种金属离子形成稳定的配合物,结构如图所示。具有惰性气体结构的阳离子与EDTA形成配合物时,配位能力与二者之间的静电引力成正比。

与EDTA形成的配合物稳定性相对较高的是_______ (填“ ”或“
”或“ ”)EDTA与
”)EDTA与 形成配合物时需严格控制pH,不能太低太高,原因是
形成配合物时需严格控制pH,不能太低太高,原因是_______ 。
 简称EDTA,白色粉末,微溶于冷水,是一种重要的络合剂。实验室常用氯乙酸
简称EDTA,白色粉末,微溶于冷水,是一种重要的络合剂。实验室常用氯乙酸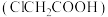 、乙二胺
、乙二胺 、NaOH为原料制备EDTA,操作步骤及反应装置如下(夹持装置略):
、NaOH为原料制备EDTA,操作步骤及反应装置如下(夹持装置略):

回答下列问题:
(1)制备氯乙酸钠时,能否用
 替代
替代
(2)仪器A的名称是
(3)制备乙二胺四乙酸四钠宜采用的加热方式为
(4)EDTA的产率为
(5)EDTA可与多种金属离子形成稳定的配合物,结构如图所示。具有惰性气体结构的阳离子与EDTA形成配合物时,配位能力与二者之间的静电引力成正比。

与EDTA形成的配合物稳定性相对较高的是
 ”或“
”或“ ”)EDTA与
”)EDTA与 形成配合物时需严格控制pH,不能太低太高,原因是
形成配合物时需严格控制pH,不能太低太高,原因是
您最近半年使用:0次