解题方法
1 .  (三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐
(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐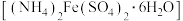 制备
制备 的流程如图所示。
的流程如图所示。

回答下列问题:
(1)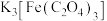 中铁离子的配位数为
中铁离子的配位数为__________ ,其配体 中C原子的杂化方式为
中C原子的杂化方式为________ 。
(2)步骤②发生反应的化学方程式为__________________________________________________ 。
(3)步骤③将 加入到
加入到 溶液中,水浴加热,控制溶液pH为
溶液中,水浴加热,控制溶液pH为 ,随反应进行需加入适量
,随反应进行需加入适量__________ (已知:常温下 溶液的pH约为3.5)。
溶液的pH约为3.5)。
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是____________________ 。
(5)某研究小组将 在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和
在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和 。
。

①按气流从左到右的方向,依次连接的合理顺序为_________________ (填装置序号)。
②确认气体产物中含CO的现象为____________________ 。
 (三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐
(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐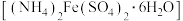 制备
制备 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)
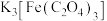 中铁离子的配位数为
中铁离子的配位数为 中C原子的杂化方式为
中C原子的杂化方式为(2)步骤②发生反应的化学方程式为
(3)步骤③将
 加入到
加入到 溶液中,水浴加热,控制溶液pH为
溶液中,水浴加热,控制溶液pH为 ,随反应进行需加入适量
,随反应进行需加入适量 溶液的pH约为3.5)。
溶液的pH约为3.5)。(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是
(5)某研究小组将
 在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和
在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和 。
。
①按气流从左到右的方向,依次连接的合理顺序为
②确认气体产物中含CO的现象为
您最近半年使用:0次
2020-11-24更新
|
590次组卷
|
4卷引用:山东省临沂市2021届高三上学期期中考试化学试题
名校
解题方法
2 . 用下列实验方案或装置进行实验,不能达到相应实验目的的是
| 选项 | A | B | C | D |
| 实验方案或装置 |  | 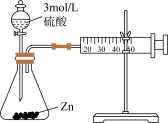 | 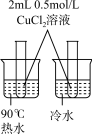 | 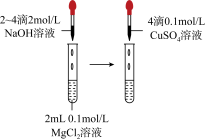 |
| 实验目的 | 中和热的测定 | 测定锌与稀硫酸反应的化学反应速率 | 探究温度对化学平衡的影响 | 比较Mg(OH)2与Cu(OH)2的Ksp大小 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 电镀实验在生产生活中应用广泛。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是___________ (填阴极或阳极),对应的电极方程式为:___________ ;如图装置电解一段时间后,溶液中___________ (填微粒化学式)浓度下降,从而影响镀铜的速率和质量。
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)实验①中,无色气体产生的原因是 或
或___________ 。
(3)实验①中,气体减少,推测是由于溶液中 减少,且
减少,且___________ 。
(4)欲测定实验①溶液中 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的___________ ,用 标准溶液滴定时应选用
标准溶液滴定时应选用___________ 滴定管(填“酸式”或“碱式”)。
(5)为确定实验①电解质溶液中 的准确浓度
的准确浓度 ,实验操作为:准确量取
,实验操作为:准确量取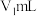 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用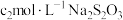 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: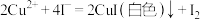 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为___________ ,滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液___________ 。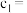
___________ (用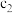 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果___________ (填“偏大”“偏小”或“无影响”)。
(6)实验②中, 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为___________ ,反应后的体系呈___________ 色。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
| 装置示意图 | 序号 | 电解质溶液 | 实验现象 |
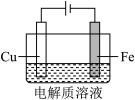 | ① | 0.1mol/L +少量 +少量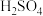 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有 生成。 生成。 |
| ② | 0.1mol/L +过量氨水 +过量氨水 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。 |
 或
或(3)实验①中,气体减少,推测是由于溶液中
 减少,且
减少,且(4)欲测定实验①溶液中
 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的 标准溶液滴定时应选用
标准溶液滴定时应选用(5)为确定实验①电解质溶液中
 的准确浓度
的准确浓度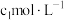 ,实验操作为:准确量取
,实验操作为:准确量取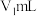 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用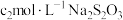 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: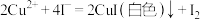 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为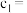
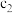 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(6)实验②中,
 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为
您最近半年使用:0次
2023-07-13更新
|
123次组卷
|
2卷引用:江西省吉安市双校联盟2022-2023学年高二下学期期中考试化学试题
名校
解题方法
4 . 某小组实验探究铜与浓硫酸的反应。
资料:i.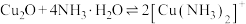 (极浅蓝色)
(极浅蓝色)
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,易溶于浓盐酸
iii.单质硫不溶于水,微溶于酒精
iv. 在干燥环境(浓
在干燥环境(浓 )中较为稳定
)中较为稳定

(1)浓 与Cu制备
与Cu制备 的化学方程式是
的化学方程式是___________ 。
(2)上述实验中能证明浓硫酸中硫酸分子的氧化性强于氢离子的实验证据是___________ 。
实验过程中,小组同学按加热时间分为三个阶段,记录实验现象如下:
(3)经检验阶段一中铜丝表面逐渐变黑的产物为 ,请从物质性质和结构角度解释产生
,请从物质性质和结构角度解释产生 原因是
原因是___________ ,发生的主要反应化学方程式是___________ 。
小组同学为探究实验中产生的沉淀,设计如下实验方案。
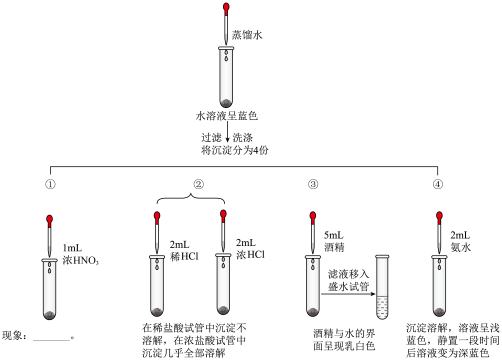
(4)实验①中可观察到的实验现象是___________ 。
(5)请用化学用语描述实验④中溶液由浅蓝色变为深蓝色的原因___________ 。
(6)通过上述实验验证可知,铜与浓硫酸反应后生成的沉淀主要成分有___________ 。
资料:i.
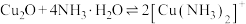 (极浅蓝色)
(极浅蓝色)
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,易溶于浓盐酸
iii.单质硫不溶于水,微溶于酒精
iv.
 在干燥环境(浓
在干燥环境(浓 )中较为稳定
)中较为稳定
(1)浓
 与Cu制备
与Cu制备 的化学方程式是
的化学方程式是(2)上述实验中能证明浓硫酸中硫酸分子的氧化性强于氢离子的实验证据是
实验过程中,小组同学按加热时间分为三个阶段,记录实验现象如下:
| 反应阶段 | 阶段一(加热初期) | 阶段二(继续加热) | 阶段三(加热后期) |
| 实验现象 | 铜丝表面逐渐变黑,溶液接近无色,无气体生成 | 大量刺激性气体产生,溶液变为墨绿色,试管底部产生灰白色沉淀 | 试管中出现“白雾”,浊液逐渐变澄清,溶液变为浅蓝,灰白色沉淀增多 |
(3)经检验阶段一中铜丝表面逐渐变黑的产物为
 ,请从物质性质和结构角度解释产生
,请从物质性质和结构角度解释产生 原因是
原因是小组同学为探究实验中产生的沉淀,设计如下实验方案。

(4)实验①中可观察到的实验现象是
(5)请用化学用语描述实验④中溶液由浅蓝色变为深蓝色的原因
(6)通过上述实验验证可知,铜与浓硫酸反应后生成的沉淀主要成分有
您最近半年使用:0次
2023-11-25更新
|
383次组卷
|
2卷引用:北京市通州区2023-2024学年高三上学期期中质量检测化学试题
5 . 某小组同学设计如图实验制备铜的配合物。
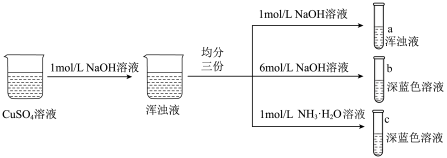
下列说法不正确 的是

下列说法
| A.硫酸铜溶液呈蓝色,是因为溶液中存在[Cu(H2O)4]2+配离子 |
| B.试管c中浑浊液变为深蓝色溶液,说明Cu(OH)2(s)生成[Cu(NH3)4]2+ |
| C.对比试管a、b、c中的现象,说明配合物的形成与配体的种类和浓度有关 |
| D.上述实验可得配离子的稳定性顺序为:[Cu(NH3)4]2+<[Cu(H2O)4]2+<[Cu(OH)4]2- |
您最近半年使用:0次
名校
解题方法
6 . 在处理NO废气的过程中,催化剂[Co(NH3)6]2+会逐渐失活变为[Co(NH3)6]3+。某小组为解决这一问题,实验研究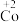 和
和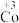 之间的相互转化。
之间的相互转化。
资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105
Co3++6NH3 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035
iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH
(1)探究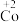 的还原性
的还原性
实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。
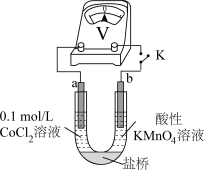
①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,____ (补全实验操作及现象),否定了该观点。
②探究碱性条件下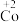 的还原性,进行实验。
的还原性,进行实验。
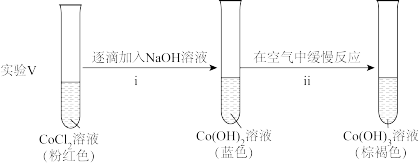
ii中反应的化学方程式是____ 。
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但____ 降低的程度更大,还原剂的还原性增强。
(2)探究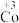 的氧化性
的氧化性
①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,____ (补全实验操作及现象),反应的离子方程式是____ 。
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是____ 。
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:____ 。
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:____ 。
示例:Co CoCl2
CoCl2 Co(OH)2
Co(OH)2
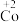 和
和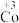 之间的相互转化。
之间的相互转化。资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3
 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105Co3++6NH3
 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH

(1)探究
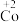 的还原性
的还原性实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,
②探究碱性条件下
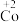 的还原性,进行实验。
的还原性,进行实验。
ii中反应的化学方程式是
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但
(2)探究
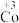 的氧化性
的氧化性①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:
示例:Co
 CoCl2
CoCl2 Co(OH)2
Co(OH)2
您最近半年使用:0次
2022-05-08更新
|
1322次组卷
|
9卷引用:北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题
7 . 某小组同学探究Cu和H2O2的反应,进行如下实验。
实验ⅰ:向装有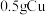 的烧杯中加入
的烧杯中加入 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)蓝色固体是_______ (填化学式)。
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料: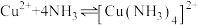 (深蓝色)
(深蓝色)
(2)实验中ⅱ:溶液变蓝的原因是_______ (用化学用语解释)。
(3)实验ⅲ中:
①深蓝色溶液含有 ,其中提供空轨道的微粒是
,其中提供空轨道的微粒是_______ ,提供孤电子对的原子是_______ 。
②对比实验ⅰ和ⅲ,为探究氨水对 的还原性或
的还原性或 氧化性的影响,利用下图装置继续实验。
氧化性的影响,利用下图装置继续实验。
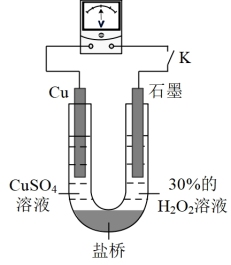
已知:电压大小反映了物质氧化性与还原性强弱的差异;差异越大,电压越大
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论是_______ ,结合化学用语解释c中电压增大的原因_______ 。利用该方法也可证明酸性增强可提高 的氧化性,导致
的氧化性,导致 溶解速率加快。
溶解速率加快。
(4)对比实验ii和iii,实验iii中产生氧气速率明显更快,可能的原因是_______ 。
(5)基于以上实验,影响Cu与 反应速率的因素有
反应速率的因素有_______ 。
实验ⅰ:向装有
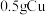 的烧杯中加入
的烧杯中加入 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。(1)蓝色固体是
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:
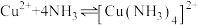 (深蓝色)
(深蓝色)| 装置 | 序号 | 试剂a | 现象 |
 | ⅱ |  与 与 混合液 混合液 |  表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ |  与 与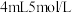 氨水混合液 氨水混合液 | 溶液立即变为深蓝色,产生大量气泡, 表面有少量蓝色不溶物 表面有少量蓝色不溶物 |
(3)实验ⅲ中:
①深蓝色溶液含有
 ,其中提供空轨道的微粒是
,其中提供空轨道的微粒是②对比实验ⅰ和ⅲ,为探究氨水对
 的还原性或
的还原性或 氧化性的影响,利用下图装置继续实验。
氧化性的影响,利用下图装置继续实验。
已知:电压大小反映了物质氧化性与还原性强弱的差异;差异越大,电压越大
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论是
 的氧化性,导致
的氧化性,导致 溶解速率加快。
溶解速率加快。(4)对比实验ii和iii,实验iii中产生氧气速率明显更快,可能的原因是
(5)基于以上实验,影响Cu与
 反应速率的因素有
反应速率的因素有
您最近半年使用:0次
名校
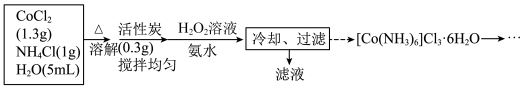
8 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3)是一种重要的含钴配合物,由CoCl2制备它的流程如下:
回答下列问题:
(1)制备装置如图所示,装混合液的仪器名称是___________ ;___________ 。
(3)实验开始,向混合液加入H2O2溶液与氨水时,应最先打开活塞___________ (填字母代号);原料中加入NH4Cl有利于后续钴离子的络合反应,其原因是___________ 。加入所有试剂后,水浴的温度控制在55℃左右,反应约30分钟,温度控制在55℃左右的原因是___________ ;
(4)CoCl2制备[Co(NH3)6]Cl3的总反应化学方程式为___________ 。
(5)由滤渣获取[Co(NH3)6]Cl3•6H2O的步骤:向滤渣中加入80℃左右的热水,充分搅拌后,趁热过滤,向滤液加入少量甲,冷却结晶后过滤,用乙洗涤晶体2~3次,低温干燥,得到产品2.14g。
①下列选项合理的是___________ (填标号)。
A.甲为浓盐酸,乙为水 B.甲为乙醇,乙为水 C.甲为浓盐酸,乙为乙醇
②该反应的产率为___________
回答下列问题:
(1)制备装置如图所示,装混合液的仪器名称是

(3)实验开始,向混合液加入H2O2溶液与氨水时,应最先打开活塞
(4)CoCl2制备[Co(NH3)6]Cl3的总反应化学方程式为
(5)由滤渣获取[Co(NH3)6]Cl3•6H2O的步骤:向滤渣中加入80℃左右的热水,充分搅拌后,趁热过滤,向滤液加入少量甲,冷却结晶后过滤,用乙洗涤晶体2~3次,低温干燥,得到产品2.14g。
①下列选项合理的是
A.甲为浓盐酸,乙为水 B.甲为乙醇,乙为水 C.甲为浓盐酸,乙为乙醇
②该反应的产率为
您最近半年使用:0次
2023-11-11更新
|
180次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高三上学期11月期中化学试题
名校
解题方法
9 . 完成下述实验,装置或试剂不正确的是
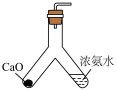 |  | 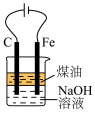 | 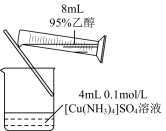 |
| A. 制备NH3 | B. 测量 O2体积 | C. 制备Fe(OH)2 | D.制备晶体Cu(NH3)4SO4·H2O |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
10 . 氯化亚铜(化学式可表示为CuCl)常用作有机合成工业中的催化剂,微溶于水、不溶于乙醇,在潮湿空气中易水解、易被氧化。某学习小组用工业废渣(主要成分为Cu2S和Fe2O3)制取CuCl并同时得到电路板蚀刻液,实验步骤如图:
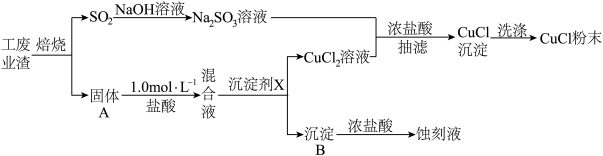
已知:
根据以上信息回答下列问题:
(1)写出焙烧过程中产生SO2的化学方程式:______ ;实验室中常用亚硫酸钠固体与70%的浓硫酸制备二氧化硫,若要达到控制反应速率的目的,图中可选用的装置是_____ (填标号)。
A.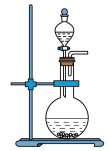 B.
B.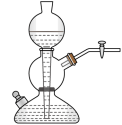 C.
C. D.
D.
(2)混合液中加入的沉淀剂X可为______ ;(填化学式),调节溶液的pH至______ ,过滤得到CuCl2溶液。
(3)①向Na2SO3溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为______ 。
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为_____→_____→E→_____(填标号)。______
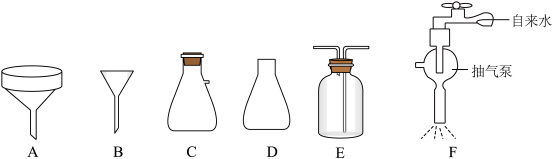
下列有关抽滤的说法错误的是_____ (填标号)。
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是______ 。
(4)实验测得氯化亚铜蒸气的相对分子质量为199,则氯化亚铜的分子式为_____ ;氯化亚铜定量吸收CO后形成配合物Cu2(CO)2Cl2·2H2O(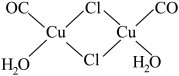 ),则Cu2(CO)2Cl2·2H2O中的配位体为
),则Cu2(CO)2Cl2·2H2O中的配位体为_____ (填化学式)。

已知:
| 金属阳离子 | 开始沉淀的pH | 完全沉淀的pH |
| Cu2+ | 4.8 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
(1)写出焙烧过程中产生SO2的化学方程式:
A.
 B.
B. C.
C. D.
D.
(2)混合液中加入的沉淀剂X可为
(3)①向Na2SO3溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为_____→_____→E→_____(填标号)。

下列有关抽滤的说法错误的是
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是
(4)实验测得氯化亚铜蒸气的相对分子质量为199,则氯化亚铜的分子式为
 ),则Cu2(CO)2Cl2·2H2O中的配位体为
),则Cu2(CO)2Cl2·2H2O中的配位体为
您最近半年使用:0次
2023-03-16更新
|
655次组卷
|
5卷引用:广西壮族自治区玉林市2022-2023学年高二下学期期中考试化学试题
广西壮族自治区玉林市2022-2023学年高二下学期期中考试化学试题河北省邯郸市2023届高三一模考试化学试题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(实验综合题)(已下线)专题16 实验题(已下线)工业流程题



