名校
1 . 一水硫酸四氨合铜 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
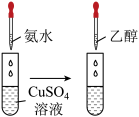
Ⅰ.制备少量晶体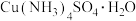 ,设计实验方案如下:
,设计实验方案如下:

(1)仪器A的名称为_____ ,对比铜和浓硫酸加热制备硫酸铜,该方案的优点是_____ 。
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是_____ 。
Ⅱ.氨含量的测定。精确称取 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10%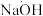 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
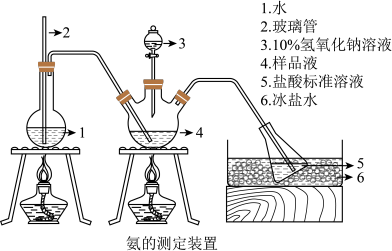
(3)“玻璃管2”的作用_____ ,样品中氨的质量分数的表达式_____ 。
Ⅲ.探究四氨合铜离子的性质
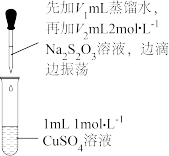
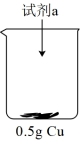
用所得晶体配成水溶液,取三份1 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
(4)上述实验现象与配位离子的解离平衡有关,请用适当的化学用语表示该配位离子的解离平衡_____ ,则加入氢氧化钠溶液后的现象为_____ 。
 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题Ⅰ.制备少量晶体
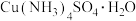 ,设计实验方案如下:
,设计实验方案如下:
(1)仪器A的名称为
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是
Ⅱ.氨含量的测定。精确称取
 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10%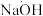 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
(3)“玻璃管2”的作用
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1
 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:| 加入试剂 | 水 | 稀硫酸 | 氢氧化钠 |
| 现象 | 几乎无变化 | 溶液颜色变成浅蓝色,与同浓度硫酸铜颜色相当 |
您最近半年使用:0次
2023-08-16更新
|
258次组卷
|
3卷引用:湖北省武汉部分重点高中2023-2024学年高三上学期8月联考化学试题
湖北省武汉部分重点高中2023-2024学年高三上学期8月联考化学试题江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题(已下线)化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升
名校
2 . 铜及其化合物有着广泛的应用。某实验小组探究 的性质。
的性质。
I.实验准备:
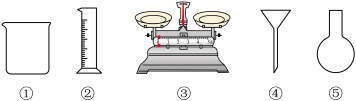
(1)由 固体配制
固体配制 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有_________ (填序号)。
实验任务:探究 溶液分别与
溶液分别与 、
、 溶液的反应
溶液的反应
查阅资料:
已知:a.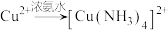 (深蓝色溶液)
(深蓝色溶液)
b. (无色溶液)
(无色溶液) (深蓝色溶液)
(深蓝色溶液)
设计方案并完成实验:
现象分析与验证:
(2)推测实验B产生的无色气体为 ,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到
,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到__________ 。
(3)推测实验B中的白色沉淀为 ,实验验证步骤如下:
,实验验证步骤如下:
①实验B完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量________ ,观察到沉淀溶解,得到无色溶液,此反应的离子方程式为__________ ;露置在空气中一段时间,观察到溶液变为深蓝色。
(4)对比实验A、B,提出假设: 增强了
增强了 的氧化性。
的氧化性。
①若假设合理,实验B反应的离子方程式为
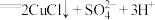 和
和__________ 。
②下述实验C证实了假设合理,装置如图8(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形__________ (补全实验操作及现象)。
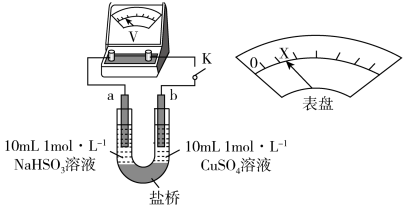
Ⅱ. 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。
(5)硫酸铜溶液呈蓝色的原因是溶液中存在配离子_________ (填化学式)。
(6)常见配合物的形成实验
 的性质。
的性质。I.实验准备:
(1)由
 固体配制
固体配制 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有
实验任务:探究
 溶液分别与
溶液分别与 、
、 溶液的反应
溶液的反应查阅资料:
已知:a.
 (深蓝色溶液)
(深蓝色溶液)b.
 (无色溶液)
(无色溶液) (深蓝色溶液)
(深蓝色溶液)设计方案并完成实验:
实验 | 装置 | 试剂x | 操作及现象 |
A |
| 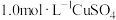 溶液 溶液 | 加入  溶液,得到绿色溶液, 溶液,得到绿色溶液, 未见明显变化。 未见明显变化。 |
B | 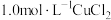 溶液 溶液 | 加入  溶液,得到绿色溶液, 溶液,得到绿色溶液, 时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
(2)推测实验B产生的无色气体为
 ,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到
,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到(3)推测实验B中的白色沉淀为
 ,实验验证步骤如下:
,实验验证步骤如下:①实验B完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量
(4)对比实验A、B,提出假设:
 增强了
增强了 的氧化性。
的氧化性。①若假设合理,实验B反应的离子方程式为

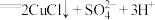 和
和②下述实验C证实了假设合理,装置如图8(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形

Ⅱ.
 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。(5)硫酸铜溶液呈蓝色的原因是溶液中存在配离子
(6)常见配合物的形成实验
实验操作 | 实验现象 | 有关离子方程式 |
| 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐 |  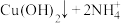   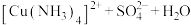 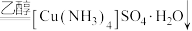 |
您最近半年使用:0次
2023-05-16更新
|
841次组卷
|
2卷引用:广东省梅州市2023届高三下学期第二次质检测试化学试题
名校
3 . 铜的配合物广泛存在,对含铜配合物的研究一直是关注的热点。
Ⅰ.同学甲设计如下制备铜的配合物的实验Ⅰ:
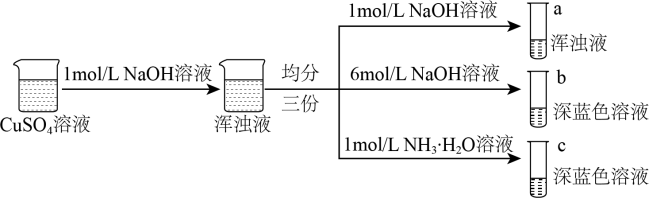
已知:铜离子的配位数通常为4, 呈深蓝色,
呈深蓝色, 呈深蓝色
呈深蓝色
(1)硫酸铜溶液呈蓝色的原因是溶液中存在配离子___________ (填化学式),配离子中配体的空间结构为___________ ,外界阴离子的空间结构___________
(2)结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因___________ 。
(3)由实验Ⅰ可得出以下结论:
结论1:配合物的形成与___________ 、___________ 有关;
结论2:结合上述实验,b、c中配体的配位能力强弱顺序为:___________ >___________ (填化学式)。
Ⅱ.同学乙查阅资料发现 与
与 在溶液中可以发生配位反应,生成配合物
在溶液中可以发生配位反应,生成配合物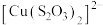 ;同学丙认为Cu(Ⅱ)有氧化性,
;同学丙认为Cu(Ⅱ)有氧化性, 与
与 在溶液中可以发生氧化还原反应。
在溶液中可以发生氧化还原反应。
【资料】
ⅰ.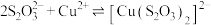 (绿色),
(绿色),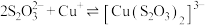 (无色);
(无色);
ⅱ. (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
实验Ⅱ:探究 与
与 溶液的反应。
溶液的反应。
(4)①丙同学认为实验Ⅱ可证明发生了氧化还原反应,他的理由是___________
②丙同学利用已知资料进一步确证了无色溶液中存在Cu(Ⅰ),他的实验方案是:取少量无色溶液,___________ 。
(5)经检验氧化产物以 形式存在,写出
形式存在,写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
(6)由实验Ⅱ可得出以下结论:
Cu(Ⅱ)盐与 在溶液中的反应与多种因素有关,随
在溶液中的反应与多种因素有关,随 的增大,
的增大,___________ 。
Ⅰ.同学甲设计如下制备铜的配合物的实验Ⅰ:

已知:铜离子的配位数通常为4,
 呈深蓝色,
呈深蓝色, 呈深蓝色
呈深蓝色(1)硫酸铜溶液呈蓝色的原因是溶液中存在配离子
(2)结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因
(3)由实验Ⅰ可得出以下结论:
结论1:配合物的形成与
结论2:结合上述实验,b、c中配体的配位能力强弱顺序为:
Ⅱ.同学乙查阅资料发现
 与
与 在溶液中可以发生配位反应,生成配合物
在溶液中可以发生配位反应,生成配合物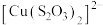 ;同学丙认为Cu(Ⅱ)有氧化性,
;同学丙认为Cu(Ⅱ)有氧化性, 与
与 在溶液中可以发生氧化还原反应。
在溶液中可以发生氧化还原反应。【资料】
ⅰ.
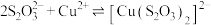 (绿色),
(绿色),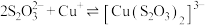 (无色);
(无色);ⅱ.
 (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。实验Ⅱ:探究
 与
与 溶液的反应。
溶液的反应。| 实验操作 | 实验序号 |  (mL) (mL) |  (mL) (mL) | 逐滴加入 溶液时的实验现象 溶液时的实验现象 |
 | a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
②丙同学利用已知资料进一步确证了无色溶液中存在Cu(Ⅰ),他的实验方案是:取少量无色溶液,
(5)经检验氧化产物以
 形式存在,写出
形式存在,写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:(6)由实验Ⅱ可得出以下结论:
Cu(Ⅱ)盐与
 在溶液中的反应与多种因素有关,随
在溶液中的反应与多种因素有关,随 的增大,
的增大,
您最近半年使用:0次
4 . 某小组同学探究Cu和H2O2的反应,进行如下实验。
实验ⅰ:向装有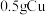 的烧杯中加入
的烧杯中加入 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)蓝色固体是_______ (填化学式)。
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料: (深蓝色)
(深蓝色)
(2)实验中ⅱ:溶液变蓝的原因是_______ (用化学用语解释)。
(3)实验ⅲ中:
①深蓝色溶液含有 ,其中提供空轨道的微粒是
,其中提供空轨道的微粒是_______ ,提供孤电子对的原子是_______ 。
②对比实验ⅰ和ⅲ,为探究氨水对 的还原性或
的还原性或 氧化性的影响,利用下图装置继续实验。
氧化性的影响,利用下图装置继续实验。
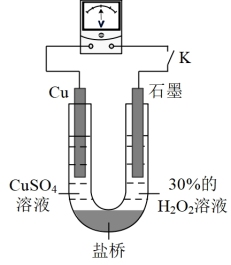
已知:电压大小反映了物质氧化性与还原性强弱的差异;差异越大,电压越大
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论是_______ ,结合化学用语解释c中电压增大的原因_______ 。利用该方法也可证明酸性增强可提高 的氧化性,导致
的氧化性,导致 溶解速率加快。
溶解速率加快。
(4)对比实验ii和iii,实验iii中产生氧气速率明显更快,可能的原因是_______ 。
(5)基于以上实验,影响Cu与 反应速率的因素有
反应速率的因素有_______ 。
实验ⅰ:向装有
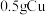 的烧杯中加入
的烧杯中加入 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。(1)蓝色固体是
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:
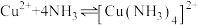 (深蓝色)
(深蓝色)| 装置 | 序号 | 试剂a | 现象 |
 | ⅱ |  与 与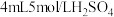 混合液 混合液 |  表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ |  与 与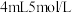 氨水混合液 氨水混合液 | 溶液立即变为深蓝色,产生大量气泡, 表面有少量蓝色不溶物 表面有少量蓝色不溶物 |
(3)实验ⅲ中:
①深蓝色溶液含有
 ,其中提供空轨道的微粒是
,其中提供空轨道的微粒是②对比实验ⅰ和ⅲ,为探究氨水对
 的还原性或
的还原性或 氧化性的影响,利用下图装置继续实验。
氧化性的影响,利用下图装置继续实验。
已知:电压大小反映了物质氧化性与还原性强弱的差异;差异越大,电压越大
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论是
 的氧化性,导致
的氧化性,导致 溶解速率加快。
溶解速率加快。(4)对比实验ii和iii,实验iii中产生氧气速率明显更快,可能的原因是
(5)基于以上实验,影响Cu与
 反应速率的因素有
反应速率的因素有
您最近半年使用:0次
名校
5 . 已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl-=[CoCl4]2-+6H2O △H,将该溶液分为三份做实验,溶液的颜色变化如表:
以下结论和解释正确的是
| 装置 | 序号 | 操作 | 现象 |
 | ① | 将试管置于冰水浴中 | 溶液均呈粉红色 |
| ② | 加水稀释 | ||
| ③ | 加少量ZnCl2固体 |
| A.由实验①可知:△H>0 |
| B.由实验②可推知加水稀释,浓度熵Q<K,平衡逆向移动 |
| C.由实验③可知:Zn2+络合Cl-能力比Co2+络合Cl-能力弱 |
| D.实验①②③可知:配合物的形成与温度、配体的浓度及配体的种类等有关 |
您最近半年使用:0次
名校
解题方法
6 . 在处理NO废气的过程中,催化剂[Co(NH3)6]2+会逐渐失活变为[Co(NH3)6]3+。某小组为解决这一问题,实验研究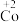 和
和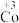 之间的相互转化。
之间的相互转化。
资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105
Co3++6NH3 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035
iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH
(1)探究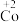 的还原性
的还原性
实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。
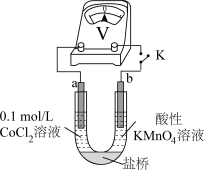
①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,____ (补全实验操作及现象),否定了该观点。
②探究碱性条件下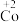 的还原性,进行实验。
的还原性,进行实验。
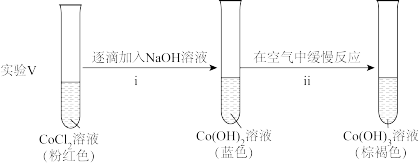
ii中反应的化学方程式是____ 。
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但____ 降低的程度更大,还原剂的还原性增强。
(2)探究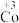 的氧化性
的氧化性
①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,____ (补全实验操作及现象),反应的离子方程式是____ 。
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是____ 。
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:____ 。
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:____ 。
示例:Co CoCl2
CoCl2 Co(OH)2
Co(OH)2
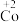 和
和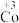 之间的相互转化。
之间的相互转化。资料:i.Ksp[Co(OH)2]=5.9×10-15,Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3
 [Co(NH3)6]2+K1=1.3×105
[Co(NH3)6]2+K1=1.3×105Co3++6NH3
 [Co(NH3)6]3+K2=2×1035
[Co(NH3)6]3+K2=2×1035iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH

(1)探究
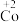 的还原性
的还原性实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,
②探究碱性条件下
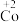 的还原性,进行实验。
的还原性,进行实验。
ii中反应的化学方程式是
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但
(2)探究
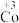 的氧化性
的氧化性①根据实验III和IV推测氧化性:Co3+>Cl2,设计实验证明:向V中得到的棕褐色沉淀中,
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是
(3)催化剂[Co(NH3)6]2+的失活与再生
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:
示例:Co
 CoCl2
CoCl2 Co(OH)2
Co(OH)2
您最近半年使用:0次
2022-05-08更新
|
1322次组卷
|
9卷引用:北京市西城区2022届高三第二次模拟测试化学试题
名校
解题方法
7 . 某小组设计一系列实验探究SO2和AgNO3溶液反应的原理。回答下列问题: 已知:Ag+能与NH3·H2O反应生成稳定的络合物[Ag(NH3)2]+。
实验(一):制备SO2并完成SO2和AgNO3溶液反应。
已知:常温下,实验室用70%浓硫酸与亚硫酸钠粉末反应制备SO2。

实验中,硝酸银溶液中产生大量白色沉淀,过滤得到灰白色沉淀A和无色溶液B。
(1)制备SO2的发生装置宜选择___________(填标号)。
(2)饱和NaHSO3溶液的作用是___________ 。
实验(二):探究灰白色沉淀A的成分。
步骤1:向沉淀A中加入足量的浓氨水,灰白色沉淀逐渐减少,得到灰黑色浊液。
步骤2:静置一段时间,取上层清液于试管中,加入浓硝酸,产生红棕色气体。
(3)经检验,灰黑色浊液中的固体是银单质,则每生成1 mol银转移的电子的物质的量为___________ mol。
(4)灰白色沉淀A与浓氨水发生反应的离子方程式为___________ (写出一个即可)。
实验(三):探究无色溶液B的成分。
已知:AgCl溶于浓盐酸生成[AgCl2]-
操作与现象:
将无色溶液B分成两份,向一份溶液中滴加浓盐酸,先产生白色沉淀,后沉淀溶解;向另一份溶液中加入饱和Na2SO3溶液,试管中无沉淀产生。
(5)补充实验:向0.1 mol •L-1的AgNO3溶液中滴加饱和Na2SO3溶液,有白色沉淀产生。由此推知,无色溶液B中___________ (填“存在”或“不存在”) Ag+。
(6)经检验发现此溶液中含有[Ag(SO3)2]3-,用平衡移动原理解释向溶液B中滴加浓盐酸出现白色沉淀的原因:___________ 。
(7)取少量无色溶液B,滴加盐酸酸化的氯化钡溶液,产生白色沉淀,有同学认为是由于空气中的O2参与了反应,设计实验探究该同学的猜想:___________ 。
(8)通过上述实验,可以推出SO2与AgNO3溶液反应包括氧化还原反应和复分解反应。由此推知:Fe3+和SO 不能大量共存的原因有两种:一种是2Fe3++3SO
不能大量共存的原因有两种:一种是2Fe3++3SO +6H2O=2Fe(OH)3↓+3H2SO3,另一种是
+6H2O=2Fe(OH)3↓+3H2SO3,另一种是___________ (用离子方程式表示)。
实验(一):制备SO2并完成SO2和AgNO3溶液反应。
已知:常温下,实验室用70%浓硫酸与亚硫酸钠粉末反应制备SO2。

实验中,硝酸银溶液中产生大量白色沉淀,过滤得到灰白色沉淀A和无色溶液B。
(1)制备SO2的发生装置宜选择___________(填标号)。
A.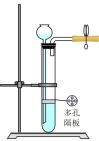 | B.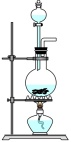 | C.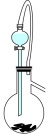 | D. |
实验(二):探究灰白色沉淀A的成分。
步骤1:向沉淀A中加入足量的浓氨水,灰白色沉淀逐渐减少,得到灰黑色浊液。
步骤2:静置一段时间,取上层清液于试管中,加入浓硝酸,产生红棕色气体。
(3)经检验,灰黑色浊液中的固体是银单质,则每生成1 mol银转移的电子的物质的量为
(4)灰白色沉淀A与浓氨水发生反应的离子方程式为
实验(三):探究无色溶液B的成分。
已知:AgCl溶于浓盐酸生成[AgCl2]-
操作与现象:
将无色溶液B分成两份,向一份溶液中滴加浓盐酸,先产生白色沉淀,后沉淀溶解;向另一份溶液中加入饱和Na2SO3溶液,试管中无沉淀产生。
(5)补充实验:向0.1 mol •L-1的AgNO3溶液中滴加饱和Na2SO3溶液,有白色沉淀产生。由此推知,无色溶液B中
(6)经检验发现此溶液中含有[Ag(SO3)2]3-,用平衡移动原理解释向溶液B中滴加浓盐酸出现白色沉淀的原因:
(7)取少量无色溶液B,滴加盐酸酸化的氯化钡溶液,产生白色沉淀,有同学认为是由于空气中的O2参与了反应,设计实验探究该同学的猜想:
(8)通过上述实验,可以推出SO2与AgNO3溶液反应包括氧化还原反应和复分解反应。由此推知:Fe3+和SO
 不能大量共存的原因有两种:一种是2Fe3++3SO
不能大量共存的原因有两种:一种是2Fe3++3SO +6H2O=2Fe(OH)3↓+3H2SO3,另一种是
+6H2O=2Fe(OH)3↓+3H2SO3,另一种是
您最近半年使用:0次
8 . [Co(en)2Cl2]Cl配合物存在顺反异构现象。制备trans-[Co(en)2Cl2]Cl的实验过程如下。

乙二胺缩写为en,实验过程含钴离子依次发生如下变化:[Co(H2O)6]2+→[Co(en)2(H2O)2]2+→[Co(en)2(H2O)2]3+→[Co(en)2C12]+
(1)“溶解”过程Co(II)的配位数_______ 变化(填“发生”或“未发生”)。
(2)“氧化”过程Co(II)转化为Co(III)的离子方程式为_______ 。
(3)“氯化”过程使用浓盐酸而不用NaCl。浓盐酸的作用有_______ 。
(4)“蒸发浓缩”至_______ 停止加热。
(5)trans-[Co(en)2Cl2]Cl转化为cis-[Co(en)2Cl2]Cl的实验如下。

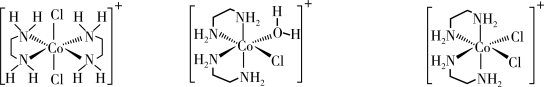
①由上述实验可知;生成trans-[Co(en)2Cl2]Cl是_______ 决速(填“热力学”或“动力学”,下同),生成cis-[Co(en)2Cl2]Cl是_______ 决速。
②设计实验将cis-[Co(en)2Cl2]Cl转化为trans-[Co(en)2Cl2]Cl_______ 。

乙二胺缩写为en,实验过程含钴离子依次发生如下变化:[Co(H2O)6]2+→[Co(en)2(H2O)2]2+→[Co(en)2(H2O)2]3+→[Co(en)2C12]+
(1)“溶解”过程Co(II)的配位数
(2)“氧化”过程Co(II)转化为Co(III)的离子方程式为
(3)“氯化”过程使用浓盐酸而不用NaCl。浓盐酸的作用有
(4)“蒸发浓缩”至
(5)trans-[Co(en)2Cl2]Cl转化为cis-[Co(en)2Cl2]Cl的实验如下。


①由上述实验可知;生成trans-[Co(en)2Cl2]Cl是
②设计实验将cis-[Co(en)2Cl2]Cl转化为trans-[Co(en)2Cl2]Cl
您最近半年使用:0次
名校
9 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象与结论 | |
| A | 验证压强对化学平衡的影响 | 先将注射器充满NO2气体,然后将活塞往里推压缩体积 | 观察到注射器内气体颜色加深,证明加压平衡朝生成NO2气体的方向移动 |
| B | 铜的电解精炼 | 待精炼的铜和纯铜连接外加直流电源的阳极和阴极,用硫酸铜溶液作电解质电解 | 阳极上铜逐渐溶解,阴极上铜逐渐析出,硫酸铜溶液浓度保持不变 |
| C | 制备[Cu(NH3)4]SO4·H2O晶体 | 向4mL 0.1mol/LCuSO4溶液中滴加氨水,先形成难溶物,并继续滴加沉淀溶解,然后蒸发溶剂析出晶体 | 反应过程中,NH3的N给出孤对电子,Cu2+接受电子对,形成了稳定的配位键[Cu(NH3)4]2+ |
| D | 除去锅炉水垢中的CaSO4 | 先用碳酸钠溶液浸泡水垢,然后再用盐酸除去 | 利用Ksp(CaSO4)> Ksp(CaCO3),实现沉淀的转化 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-01-21更新
|
404次组卷
|
4卷引用:浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题
浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题(已下线)3.4 配合物与超分子-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)浙江省富阳区第二中学2021-2022学年高二下学期(3月)检测化学试题 河北鸡泽县第一中学2021-2022学年高二下学期开学考试化学试题
解题方法
10 . 含钴配合物在催化、药物和材料科学领域具有广泛应用,在不同的制备条件下,钴可以形成多种配位结构。三氯化六氨合钴(Ⅲ)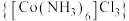 是一种重要的含钴配合物,实验室可用活性炭为催化剂,由
是一种重要的含钴配合物,实验室可用活性炭为催化剂,由 、浓氨水、
、浓氨水、 、
、 制备。
制备。
已知:① 在溶液中较稳定;
在溶液中较稳定; 具有较强还原性;
具有较强还原性;
②常温下,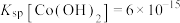 。
。
实验过程操作步骤如下(省略加热和夹持装置): 固体溶在水中,加入研细的
固体溶在水中,加入研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。
步骤2:实验装置如图,将混合溶液转移至三颈烧瓶中,加入活性炭,再加入 溶液与浓氨水,水浴加热至55℃,保持20min。
溶液与浓氨水,水浴加热至55℃,保持20min。
步骤3:趁热过滤,冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到 粗产品。
粗产品。
回答下列问题:
(1)仪器c的名称是______ ,d中无水 的作用是
的作用是______ 。
(2)步骤1中,加入 有利于后续配离子的生成,其原因是
有利于后续配离子的生成,其原因是______ 。
(3)步骤2中,加入 溶液与浓氨水时,应先打开活塞
溶液与浓氨水时,应先打开活塞______ (填“a”或“b”)。
(4)步骤3中加入浓盐酸的目的是______ 。
(5) 制备
制备 的总反应化学方程式为
的总反应化学方程式为______ 。
(6)已知 是以
是以 为中心的正八面体结构(如图所示),若其中2个
为中心的正八面体结构(如图所示),若其中2个 被
被 取代,则所形成的
取代,则所形成的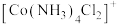 的空间结构有
的空间结构有______ 种。 ,向含0.1mol该配合物溶液中加入足量
,向含0.1mol该配合物溶液中加入足量 溶液,得到白色沉淀28.7g,其配离子的化学式为
溶液,得到白色沉淀28.7g,其配离子的化学式为______ 。
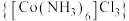 是一种重要的含钴配合物,实验室可用活性炭为催化剂,由
是一种重要的含钴配合物,实验室可用活性炭为催化剂,由 、浓氨水、
、浓氨水、 、
、 制备。
制备。已知:①
 在溶液中较稳定;
在溶液中较稳定; 具有较强还原性;
具有较强还原性;②常温下,
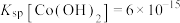 。
。实验过程操作步骤如下(省略加热和夹持装置):
 固体溶在水中,加入研细的
固体溶在水中,加入研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。步骤2:实验装置如图,将混合溶液转移至三颈烧瓶中,加入活性炭,再加入
 溶液与浓氨水,水浴加热至55℃,保持20min。
溶液与浓氨水,水浴加热至55℃,保持20min。步骤3:趁热过滤,冷却后加入适量浓盐酸,过滤、洗涤、干燥,得到
 粗产品。
粗产品。回答下列问题:
(1)仪器c的名称是
 的作用是
的作用是(2)步骤1中,加入
 有利于后续配离子的生成,其原因是
有利于后续配离子的生成,其原因是(3)步骤2中,加入
 溶液与浓氨水时,应先打开活塞
溶液与浓氨水时,应先打开活塞(4)步骤3中加入浓盐酸的目的是
(5)
 制备
制备 的总反应化学方程式为
的总反应化学方程式为(6)已知
 是以
是以 为中心的正八面体结构(如图所示),若其中2个
为中心的正八面体结构(如图所示),若其中2个 被
被 取代,则所形成的
取代,则所形成的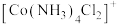 的空间结构有
的空间结构有
 ,向含0.1mol该配合物溶液中加入足量
,向含0.1mol该配合物溶液中加入足量 溶液,得到白色沉淀28.7g,其配离子的化学式为
溶液,得到白色沉淀28.7g,其配离子的化学式为
您最近半年使用:0次



 溶液
溶液