解题方法
1 . 纳米银粉具有特殊的化学活性,用途广泛,某研究小组制备纳米银粉并进而制备Ag电极的流程如下:

已知:①AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
②向硝酸银溶液中加入氨水,转化为Ag2O的AgNO3占参加反应的AgNO3总量的百分比最大不超过10%。
③
请回答:
(1)银氨溶液中主要含Ag元素的离子是_______ 。(填化学式)
(2)下列有关说法不正确 的是_______。
(3)步骤I,向1 mL 2% AgNO3(HNO3酸化)溶液中逐滴加入2%氨水至过量,溶液始终澄清,原因为_______ 。
(4)AgNO3溶液可用于滴定分析某CuCl2粗品中CuCl2的含量。从下列选项中选择合理的仪器和操作,补全如下步骤_______ [“_______”上填写一件最关键仪器 ,“ ”内填写一种操作 ,“[ ]”内填写一种试剂 ,均用字母表示]。
用分析天平称量CuCl2粗品xg→加入_______中→用_______“ ”加入前置 容器中→加入[ ]做指示剂→用滴定管(盛装NH4SCN标准溶液)滴定至终点。
仪器:a.烧杯;b.锥形瓶;c.酸式滴定管;d.碱式滴定管
操作:e.配置一定体积的CuCl2溶液;f.酸溶样品;g.量取一定体积一定浓度的AgNO3溶液
试剂:h.甲基橙;i.酚酞;j.NH4Fe(SO4)2溶液
(5)用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米 Ag。
①该体系中的维生素C的作用为_______ 。
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。

明胶在该体系中的功能为_______ 。

已知:①AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
②向硝酸银溶液中加入氨水,转化为Ag2O的AgNO3占参加反应的AgNO3总量的百分比最大不超过10%。
③

请回答:
(1)银氨溶液中主要含Ag元素的离子是
(2)下列有关说法
| A.步骤I,银氨溶液也可用AgCl与氨水反应制得 |
| B.步骤II,若反应温度过高,反应速率过快,分散剂来不及包裹生成的银粉,发生二次团聚,不利于纳米银粉的制备 |
| C.步骤III,为了加快过滤速度,可以采用抽滤 |
| D.步骤IV,将有机载体与纳米银粉均匀混合的操作是研磨 |
(4)AgNO3溶液可用于滴定分析某CuCl2粗品中CuCl2的含量。从下列选项中选择合理的仪器和操作,补全如下步骤
用分析天平称量CuCl2粗品xg→加入_______中→用_______“ ”加入
仪器:a.烧杯;b.锥形瓶;c.酸式滴定管;d.碱式滴定管
操作:e.配置一定体积的CuCl2溶液;f.酸溶样品;g.量取一定体积一定浓度的AgNO3溶液
试剂:h.甲基橙;i.酚酞;j.NH4Fe(SO4)2溶液
(5)用AgNO3溶液与维生素C以及明胶在一定条件下也可制得
①该体系中的维生素C的作用为
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。

明胶在该体系中的功能为
您最近一年使用:0次
名校
解题方法
2 . 水合硫酸四氨合铜 在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是
在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是
 在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是
在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是A. 中 中 的空间结构为平面三角形 的空间结构为平面三角形 |
B. 的配位数是6 的配位数是6 |
C. 分子中 分子中 键的键角大于 键的键角大于 分子中 分子中 键的键角 键的键角 |
D. 和 和 与 与 的配位能力: 的配位能力: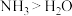 |
您最近一年使用:0次
2022-08-22更新
|
150次组卷
|
2卷引用:江苏省锡东高级中学2023-2024学年高二上学期期中考试化学试卷
20-21高三·江苏·开学考试
3 . 铁及其化合物用途广泛。日常生活用品和生命体中,有许多含有铁元素的物质。家用铁锅中含有铁和碳,补血剂中含有FeCO3,血红蛋白的活性物质血红素(结构简式如图)中含有铁元素,激光打印机中含有四氧化三铁。四氧化三铁可利用废旧镀锌铁皮制备。

利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程图如下:

已知:Zn溶于强碱时生成[Zn(OH)4]2-。
下列有关说法正确的是

利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程图如下:

已知:Zn溶于强碱时生成[Zn(OH)4]2-。
下列有关说法正确的是
| A.1mol[Zn(OH)4]2-中含有4molσ键 |
| B.“酸溶”的离子方程式为Fe(OH)3+3H+=Fe3++3H2O |
C.“氧化”后溶液中所存在的离子有:H+、Fe2+、Fe3+、 |
| D.血红素中C、N、O、Fe元素的第一电离能由大到小的顺序是Fe>N>O>C |
您最近一年使用:0次
解题方法
4 . [Cu(NH3)4]SO4是一 种深蓝色的配位化合物。
(1)Cu2+可被还原成Cu+,Cu+基态核外的外围电子排布式为_________________________ 。
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,则该分子中N原子的杂化轨道类型为______________________ 。
(3)与CS2分子互为等电子体的SCN-离子的电子式为_________________ 。
(4) Cu可形成多种配合物,且各种配合物有广乏的用途。某Cu的配合物结构如图1所示,则该配合物中心原子Cu的配体数为____ ; 其分子内含有的作用力有________ (填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键


(5)Cu元素与S元素形成的一种化合物品跑如图2所示,其中S的配位数为______________ 。
(1)Cu2+可被还原成Cu+,Cu+基态核外的外围电子排布式为
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,则该分子中N原子的杂化轨道类型为
(3)与CS2分子互为等电子体的SCN-离子的电子式为
(4) Cu可形成多种配合物,且各种配合物有广乏的用途。某Cu的配合物结构如图1所示,则该配合物中心原子Cu的配体数为
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键


(5)Cu元素与S元素形成的一种化合物品跑如图2所示,其中S的配位数为
您最近一年使用:0次
名校
解题方法
5 . 含Ti化合物在工业生产中有着重要用途。TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2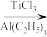

TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
TiO2+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
(1)Ti3+的基态核外电子排布式为__________ ;
(2)丙烯分子中,碳原子轨道杂化类型为__________ ;
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________ ;
(4)写出一种由第2周期元素组成且与CO互为等电子体的阴离子的电子式____ ;
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______ ;
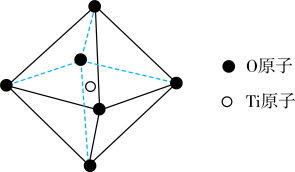
(6)钛酸锶具有超导性、热敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置(如图),据此推测,钛酸锶的化学式为_________ 。
nCH3CH=CH2
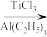

TiCl4+2Mg
 Ti+2MgCl2
Ti+2MgCl2TiO2+2C+2Cl2
 TiCl4+2CO
TiCl4+2CO(1)Ti3+的基态核外电子排布式为
(2)丙烯分子中,碳原子轨道杂化类型为
(3)Mg、Al、Cl第一电离能由大到小的顺序是
(4)写出一种由第2周期元素组成且与CO互为等电子体的阴离子的电子式
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为
(6)钛酸锶具有超导性、热敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置(如图),据此推测,钛酸锶的化学式为

您最近一年使用:0次
6 . 盐酸氯丙嗪是一种多巴胺受体的阻断剂,临床有多种用途。化合物Ⅲ是盐酸氯丙嗪制备的原料,可由化合物I和Ⅱ在铜作催化剂条件下反应制得。

(1) Cu基态核外电子排布式为________________ 。
(2) 1 mol化合物Ⅰ分子中含有σ键数目为________ 。
(3) 化合物Ⅲ分子中sp3方式杂化的原子数目是____________ 。
(4) 向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该白色沉淀中Cu、S、N的物质的量之比为1∶1∶1,沉淀中有一种三角锥形的阴离子和一种正四面体形的阳离子。
①[Cu(NH3)4]SO4中存在的化学键类型有________ (填字母)。
A. 共价键 B. 氢键 C. 离子键 D. 配位键 E. 分子间作用力
② 上述白色沉淀的化学式为____________________________ 。
(5) 铜的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式:__________________________________________________________ 。


(1) Cu基态核外电子排布式为
(2) 1 mol化合物Ⅰ分子中含有σ键数目为
(3) 化合物Ⅲ分子中sp3方式杂化的原子数目是
(4) 向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该白色沉淀中Cu、S、N的物质的量之比为1∶1∶1,沉淀中有一种三角锥形的阴离子和一种正四面体形的阳离子。
①[Cu(NH3)4]SO4中存在的化学键类型有
A. 共价键 B. 氢键 C. 离子键 D. 配位键 E. 分子间作用力
② 上述白色沉淀的化学式为
(5) 铜的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式:

您最近一年使用:0次
名校
解题方法
7 . 锌的配合物ZSM、[Zn(N2H4)2(N3)2]n等配合物及其合金用途非常广泛。
(1)Zn2+基态核外电子排布式为_____________ 。
(2)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备:
 +NH3
+NH3
①与CN-互为等电子体的分子是_____________ (写化学式)。
②2-甲基咪唑中碳原子杂化轨道类型为_____________ ;lmol2-甲基咪唑分子中含 键数目为
键数目为_________ 。N2H4易溶于水的主要的原因是_____________ 。
(3)[Zn(N2H4)2(N3)2]n有两种配体,Zn2+的配位数是6,补画出[Zn(N2H4)2(N3)2]n结构示意图:____________ 。

(1)Zn2+基态核外电子排布式为
(2)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备:
 +NH3
+NH3①与CN-互为等电子体的分子是
②2-甲基咪唑中碳原子杂化轨道类型为
 键数目为
键数目为(3)[Zn(N2H4)2(N3)2]n有两种配体,Zn2+的配位数是6,补画出[Zn(N2H4)2(N3)2]n结构示意图:

您最近一年使用:0次
名校
解题方法
8 . 铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是____ ,铜的基态原子核外电子排布式为______ 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________ 。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
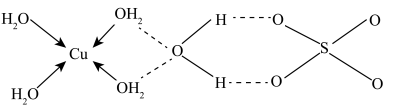
图中虚线表示_____________ ,SO42-的立体构型是__________ ,NO3-中N原子的杂化轨道类型是___________ ;O原子的价电子排布图为__________________ 。
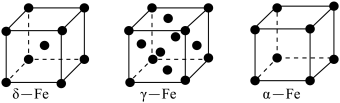
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为______ 。
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为________ 。

(1)铁元素在周期表中的位置是
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:

图中虚线表示
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为

(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如图)相似,该晶体储氢后的化学式为

您最近一年使用:0次
10-11高二下·江苏·期末
解题方法
9 . 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
⑴超细铜粉的某制备方法如下:

①[Cu(NH3)4]SO4中所含的化学键有__________________ ,
N、O、S三种元素的第一电离能大小顺序为:__________________ 。(填元素符号)
②NH4CuSO3中的金属阳离子的核外电子排布式为:________________________ 。
③ NH3分子中N原子的杂化方式为:_____________ 。
④与SO2互为等电子体的分子有________________ (写一种)。
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为_________ 。
②CuCl的熔点比CuO的熔点___________ 。(填“高”或“低”)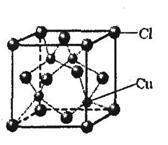
⑴超细铜粉的某制备方法如下:

①[Cu(NH3)4]SO4中所含的化学键有
N、O、S三种元素的第一电离能大小顺序为:
②NH4CuSO3中的金属阳离子的核外电子排布式为:
③ NH3分子中N原子的杂化方式为:
④与SO2互为等电子体的分子有
⑵氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。
①CuCl的晶胞结构如下图所示,其中Cl原子的配位数为
②CuCl的熔点比CuO的熔点

您最近一年使用:0次



