解题方法
1 . 原子序数依次增大的前四周期元素X、Y、Z、W中,X和Y的价电子层中未成对电子均只有1个,并且 和
和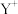 的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
(1)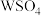 溶于氨水形成
溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中
中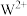 与
与 之间形成的化学键称为
之间形成的化学键称为______ ,提供孤电子对的成键原子是______ (填元素符号)。
②氨气溶于水时,大部分 与
与 以氢键(用“…”表示)结合形成
以氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为
的结构式为______ 。
③往 蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为
蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为____________ 。
(2)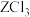 中的化学键只有明显的共价性,蒸气状态下以双聚分子形式存在的
中的化学键只有明显的共价性,蒸气状态下以双聚分子形式存在的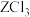 的结构式为
的结构式为______ ,其中Z的配位数为______ 。
(3)反应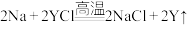 能够发生的原因为
能够发生的原因为____________ 。
 和
和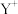 的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:
的电子数相差8;与Y位于同一周期的Z和W,它们的价电子层中的未成对电子数分别为4和2,且原子序数相差2。回答下列问题:(1)
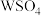 溶于氨水形成
溶于氨水形成 蓝色溶液。
蓝色溶液。①
 中
中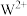 与
与 之间形成的化学键称为
之间形成的化学键称为②氨气溶于水时,大部分
 与
与 以氢键(用“…”表示)结合形成
以氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为
的结构式为③往
 蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为
蓝色溶液中滴入少量氢氧化钡溶液,该反应的离子方程式为(2)
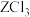 中的化学键只有明显的共价性,蒸气状态下以双聚分子形式存在的
中的化学键只有明显的共价性,蒸气状态下以双聚分子形式存在的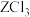 的结构式为
的结构式为(3)反应
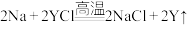 能够发生的原因为
能够发生的原因为
您最近一年使用:0次
2 . 铜的配合物在自然界中广泛存在,已知铜离子的配位数通常为4,请回答下列问题:
(1)基态29Cu的核外电子排布式为___________ 。
(2)硫酸铜溶液中存在多种微粒:
①硫酸铜溶液呈蓝色的原因是其中存在配离子___________ (填化学式),配体中提供孤电子对的原子是___________ (填元素符号)。
②SO 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为___________ 。
(3)同学甲设计如图制备铜的配合物的实验:___________ 。
②由上述实验可得出以下结论:结论1:配合物的形成与___________ 、___________ 有关。
结论2:试管b、c中深蓝色配离子的稳定性强弱顺序为:___________ >___________ (填化学式)。
(1)基态29Cu的核外电子排布式为
(2)硫酸铜溶液中存在多种微粒:
①硫酸铜溶液呈蓝色的原因是其中存在配离子
②SO
 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为(3)同学甲设计如图制备铜的配合物的实验:

②由上述实验可得出以下结论:结论1:配合物的形成与
结论2:试管b、c中深蓝色配离子的稳定性强弱顺序为:
您最近一年使用:0次
3 .  是一系列化合物,向含
是一系列化合物,向含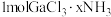 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示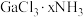 结构的化学式为
结构的化学式为_______ 。
 是一系列化合物,向含
是一系列化合物,向含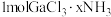 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示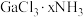 结构的化学式为
结构的化学式为
您最近一年使用:0次
4 . 盐酸氯丙嗪是一种多巴胺受体的阻断剂,临床有多种用途。化合物 是盐酸氯丙嗪制备的原料,可由化合物
是盐酸氯丙嗪制备的原料,可由化合物 和
和 在铜作催化剂条件下反应制得。
在铜作催化剂条件下反应制得。___________ 。
(2)1mol化合物 分子中含有σ键数目为
分子中含有σ键数目为___________ 。
(3)化合物 分子中sp3方式杂化的原子数目是
分子中sp3方式杂化的原子数目是___________ 。
(4)已知[Cu(NH3)4]SO4中[Cu(NH3)4]2+具有对称的空间构型,且当两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ (填序号)。
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)已知在[Cu(NH3)4]SO4中溶液中加入少量NiSO4,会立即转化为[Ni(NH3)6]SO4中,由此可知Ni2+与NH3之间形成的化学键键能___________ (填“大于”或“小于”)Cu2+与NH3之间形成的化学键键能。[Cu(NH3)4]2+中存在的化学键类型有___________ 。
 是盐酸氯丙嗪制备的原料,可由化合物
是盐酸氯丙嗪制备的原料,可由化合物 和
和 在铜作催化剂条件下反应制得。
在铜作催化剂条件下反应制得。 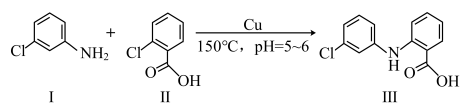
(2)1mol化合物
 分子中含有σ键数目为
分子中含有σ键数目为(3)化合物
 分子中sp3方式杂化的原子数目是
分子中sp3方式杂化的原子数目是(4)已知[Cu(NH3)4]SO4中[Cu(NH3)4]2+具有对称的空间构型,且当两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)已知在[Cu(NH3)4]SO4中溶液中加入少量NiSO4,会立即转化为[Ni(NH3)6]SO4中,由此可知Ni2+与NH3之间形成的化学键键能
您最近一年使用:0次
5 . 铁及其化合物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)1mol基态铁原子中未成对的电子数为___________ 。
(2)铁的常见氧化物中氧化铁比氧化亚铁稳定,试从原子结构角度解释原因:___________ 。
(3)铁作为过渡金属,能形成多种配位化合物。赤血盐{K3[Fe(CN)6]}为红色晶体,其配离子中提供空轨道的为___________ (填微粒符号),配位原子是___________ (填元素符号);Fe2+与1,10-邻二氮菲(phen)在水溶液中能形成稳定的螯合物,其结构如图,该螯合物中各元素的电负性由大到小的顺序为___________ ,N的杂化方式为___________ ,Fe2+的配位数为___________ 。
(1)1mol基态铁原子中未成对的电子数为
(2)铁的常见氧化物中氧化铁比氧化亚铁稳定,试从原子结构角度解释原因:
(3)铁作为过渡金属,能形成多种配位化合物。赤血盐{K3[Fe(CN)6]}为红色晶体,其配离子中提供空轨道的为

您最近一年使用:0次
6 . 向盛有CuSO4溶液的试管中加入少量氨水,现象是_______ ;继续添加氨水,得到深蓝色透明溶液,该步骤的离子方程式为_______ ;若要得到深蓝色晶体,需进行的操作是_______ ,所得晶体的化学式为_______ 。AgCl沉淀也能溶解在氨水中,生成的配合物中配体的空间结构名称为_______ ,Ag+的配位数是_______ ,继续向溶液中加入足量HNO3溶液,观察到的现象是_______ 。
您最近一年使用:0次
7 . 配位化学的应用十分广泛,在经济、生产、生活等方面都有重要作用
(1) 在水溶液中以配离子
在水溶液中以配离子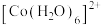 存在,在
存在,在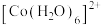 中配体是
中配体是______ ,配位原子是______ ;向含Co²⁺的水溶液中加入过量氨水可生成更稳定的 ,其原因是
,其原因是______ 。
(2)在碱性溶液中, 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。
(3)实验测得 蒸气以双聚分子(
蒸气以双聚分子(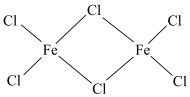 )的形式存在,其中所含化学键类型有
)的形式存在,其中所含化学键类型有______ (填字母)。
a.共价键 b.离子键 c.配位键
(4)在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”{书写时用“[ ]”与外界分离}。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如 与
与 形成的三种配合物A、B、C,
形成的三种配合物A、B、C, 的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:______ ;B:______
(1)
 在水溶液中以配离子
在水溶液中以配离子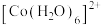 存在,在
存在,在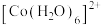 中配体是
中配体是 ,其原因是
,其原因是(2)在碱性溶液中,
 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。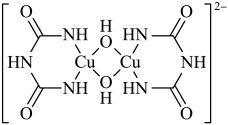
| A.该配离子与水分子可以形成氢键 |
| B.该配离子中铜离子的配位数是2 |
C.该配离子中 原子的杂化方式均是 原子的杂化方式均是 |
D.该配离子中非金属元素的电负性大小顺序为 |
(3)实验测得
 蒸气以双聚分子(
蒸气以双聚分子( )的形式存在,其中所含化学键类型有
)的形式存在,其中所含化学键类型有a.共价键 b.离子键 c.配位键
(4)在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”{书写时用“[ ]”与外界分离}。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如
 与
与 形成的三种配合物A、B、C,
形成的三种配合物A、B、C, 的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
您最近一年使用:0次
名校
8 . Ⅰ.下图装置的盐桥中盛有饱和 琼脂溶液,能够连接两份电解质溶液,形成闭合回路:
琼脂溶液,能够连接两份电解质溶液,形成闭合回路:___________ ,装置工作时,盐桥中的 移向
移向___________ 。(“ 溶液”或“
溶液”或“ 溶液”)
溶液”)
(2)若将盐桥换成n型铜丝,电路中也有电流通过,则左边装置是___________ ,(填“原电池”或“电解池”),则n型铜丝左端为___________ 极,该极电极反应式为:___________ 。
Ⅱ.配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(3) 可以形成多种配离子,如
可以形成多种配离子,如 、
、 、丁二酮肟镍分子(见图)等。
、丁二酮肟镍分子(见图)等。 中
中 键角比
键角比 分子中
分子中 键角
键角___________ (填“大”或“小”)。
②丁二酮肟镍分子内含有的作用力有___________ (填字母)。
a.配位键 b.离子键 c.氢键 d.金属键 e.共价键
(4)关于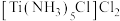 的说法中错误的是
的说法中错误的是___________ 。
A.中心原子的化合价为+3价
B.中心原子的配位数是6
C.含1mol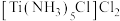 的水溶液中加入足量
的水溶液中加入足量 溶液,产生3mol白色沉淀
溶液,产生3mol白色沉淀
 琼脂溶液,能够连接两份电解质溶液,形成闭合回路:
琼脂溶液,能够连接两份电解质溶液,形成闭合回路: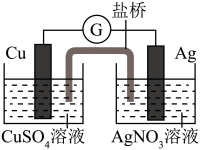
 移向
移向 溶液”或“
溶液”或“ 溶液”)
溶液”)(2)若将盐桥换成n型铜丝,电路中也有电流通过,则左边装置是
Ⅱ.配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(3)
 可以形成多种配离子,如
可以形成多种配离子,如 、
、 、丁二酮肟镍分子(见图)等。
、丁二酮肟镍分子(见图)等。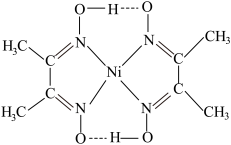
 中
中 键角比
键角比 分子中
分子中 键角
键角②丁二酮肟镍分子内含有的作用力有
a.配位键 b.离子键 c.氢键 d.金属键 e.共价键
(4)关于
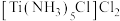 的说法中错误的是
的说法中错误的是A.中心原子的化合价为+3价
B.中心原子的配位数是6
C.含1mol
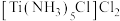 的水溶液中加入足量
的水溶液中加入足量 溶液,产生3mol白色沉淀
溶液,产生3mol白色沉淀
您最近一年使用:0次
9 . 填写下列空白:
(1)下列不属于配合物的是_______(填字母)。
(2)在配合离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是_______ ,画出配合离子[Cu(NH3)4]2+中的配位键_______ 。
(1)下列不属于配合物的是_______(填字母)。
| A.[Cu(H2O)4]SO4·H2O | B.[Ag(NH3)2]OH |
| C.KAl(SO4)2·12H2O | D.Na[Al(OH)4] |
您最近一年使用:0次
10 . I.Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式___________ 。
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为___________ 。
(3)基态 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为___________ ,其价电子轨道表示式为___________ 。
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:___________ 。为防止钢铁输水管的腐蚀,可用导线将其与镁块连接,这种防护方法为___________ 。(电化学保护法中的一种)
(5)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是___________ 。
II.制备硫酸四氨合铜晶体
①取20mL配制好的硫酸铜溶液于试管中,向其中滴加1mol/L氨水,有蓝色沉淀生成。
②继续慢慢加入氨水并振荡试管,沉淀逐渐消失,生成深蓝色溶液。
(6) 中,形成配位键提供孤电子对的原子是
中,形成配位键提供孤电子对的原子是___________ (填元素符号),1mol该微粒中,含有σ键的数目为___________  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(7)步骤②中蓝色沉淀溶解的离子方程式为___________ 。
(8)步骤③中加入无水乙醇的目的是___________ 。
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为
(3)基态
 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为(4)钢铁发生吸氧腐蚀时正极的电极反应式为:
(5)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是II.制备硫酸四氨合铜晶体
①取20mL配制好的硫酸铜溶液于试管中,向其中滴加1mol/L氨水,有蓝色沉淀生成。
②继续慢慢加入氨水并振荡试管,沉淀逐渐消失,生成深蓝色溶液。
③再向试管中加入15mL无水乙醇,混合后静置30分钟,有深蓝色晶体析出
(6)
 中,形成配位键提供孤电子对的原子是
中,形成配位键提供孤电子对的原子是 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(7)步骤②中蓝色沉淀溶解的离子方程式为
(8)步骤③中加入无水乙醇的目的是
您最近一年使用:0次



