解题方法
1 . 卤族元素的化合物在科研和生产中有着重要的作用。请回答下列问题:
(1) (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为______ ;
______ (填“是”或“否”)具有极性;基态碘原子价电子排布式为______ 。
(2)物质磁性大小以磁矩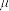 表示,
表示,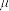 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: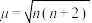 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为______ 。
a. b.
b.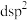 c.
c.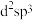
配合物 中配离子
中配离子 的
的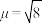 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为______ 。
(3)在极高压强下,氯化钠可以和氯气化合生成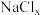 。
。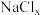 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为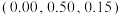 、
、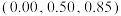 ,晶体的化学式为
,晶体的化学式为______ ;与Na距离最近的且相等的Cl有______ 个; 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为______ nm(保留2位有效数字)。
(1)
 (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为
(2)物质磁性大小以磁矩
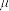 表示,
表示,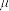 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: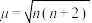 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为a.
 b.
b.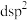 c.
c.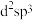
配合物
 中配离子
中配离子 的
的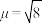 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为(3)在极高压强下,氯化钠可以和氯气化合生成
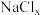 。
。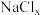 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为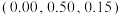 、
、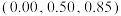 ,晶体的化学式为
,晶体的化学式为 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为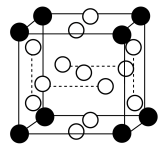
您最近半年使用:0次
2 . 下列有关物质结构与性质的说法错误的是
| A.乙醇可与水互溶,是因为乙醇分子与水分子之间形成了氢键 |
B.熔融 能导电,是由于熔融状态下产生了自由移动的 能导电,是由于熔融状态下产生了自由移动的 和 和 |
| C.超分子是两种或两种以上的分子(包括离子)通过化学键形成的分子聚集体 |
D. 溶于氨水,是由于 溶于氨水,是由于 与 与 反应生成了可溶性配合物 反应生成了可溶性配合物 |
您最近半年使用:0次
3 . 某小组同学向 溶液中匀速滴加氨水,实验数据及现象记录如下:
溶液中匀速滴加氨水,实验数据及现象记录如下:
经检测,蓝绿色沉淀为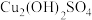 。下列说法正确的是
。下列说法正确的是
 溶液中匀速滴加氨水,实验数据及现象记录如下:
溶液中匀速滴加氨水,实验数据及现象记录如下:时间/s | 0~20 | 20~94 | 94~144 | 144~430 |
pH | 从5.2升高至5.9 | 从5.9升高至6.8 | 从6.8升高至9.5 | 从9.5升高至11.2 |
现象 | 无明显现象 | 产生蓝绿色沉淀,并逐渐增多 | 无明显变化 | 蓝绿色沉淀溶解,溶液变为深蓝色 |
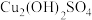 。下列说法正确的是
。下列说法正确的是A.0s时, 是因为 是因为 |
B.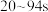 ,主要反应的离子方程式为 ,主要反应的离子方程式为 |
| C.从94s到144s,混合液中水的电离程度增大 |
D.从144s到430s,pH升高与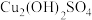 转化为 转化为 的反应有关 的反应有关 |
您最近半年使用:0次
4 . 工业锌粉常用于制造防锈漆等,其主要成分为金属锌,还有少量含锌化合物及其他杂质,锌单质的含量及锌元素的总量影响着工业锌粉的等级。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:_________ 。
(2)酸性介质中电沉积制锌粉:以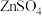 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
①阴极的电极反应有_________ 。
②制得65g锌粉时,电解质溶液中 的物质的量至少增加
的物质的量至少增加_________ mol。
(3)离子液体电沉积制锌:80℃时,将 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:_________ 。
i.二甲酚橙(In)与 反应:
反应:
EDTA与 反应:
反应: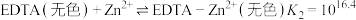
ii. 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
(4)滴定终点时的现象是_________ 。
(5)计算样品中锌元素的质量分数还需要的实验数据有_________ 。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入
 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:(2)酸性介质中电沉积制锌粉:以
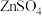 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。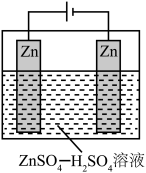

①阴极的电极反应有
②制得65g锌粉时,电解质溶液中
 的物质的量至少增加
的物质的量至少增加(3)离子液体电沉积制锌:80℃时,将
 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因: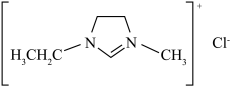

i.二甲酚橙(In)与
 反应:
反应:
EDTA与
 反应:
反应: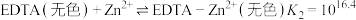
ii.
 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。(4)滴定终点时的现象是
(5)计算样品中锌元素的质量分数还需要的实验数据有
您最近半年使用:0次
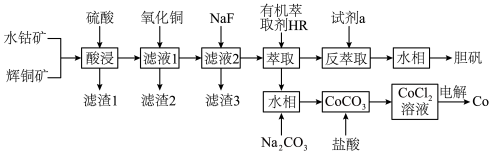
5 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶4∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近半年使用:0次
解题方法
6 . 副族元素 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液_______ ;锰在周期表中的_______ 区。
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为_______ 。
(3)副族元素 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是_______ ; 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是_______ (填元素符号),其中配体中C原子的杂化方式为_______ , 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为_______ 。
(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是_______ 。
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。_______ ;
② 的熔点
的熔点_______ (填“>”、“<”或“=”) ;
;
③若该八面体边长为 ,则晶胞的密度为
,则晶胞的密度为
_______  (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液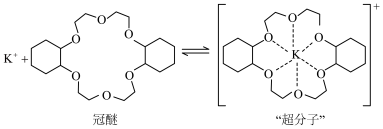
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为
(3)副族元素
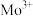 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。

②
 的熔点
的熔点 ;
;③若该八面体边长为
 ,则晶胞的密度为
,则晶胞的密度为
 (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
您最近半年使用:0次
7 . 实验室以废铜屑(含少量Fe、不溶性杂质)为原料制取 晶体和
晶体和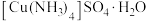 晶体,其实验流程如下:
晶体,其实验流程如下:
(1)基态Cu原子核外电子排布式为______ 。
(2)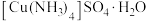 中,中心离子为
中,中心离子为_____ ,其配位数为_____ ,配体是_____ 。
(3)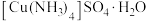 中,存在的化学键有
中,存在的化学键有______ (填字母)。
a.离子键 b.非极性共价键 c.极性共价键 d.配位键 e.氢键
(4)“氧化”时,在如图所示的装置中进行。从长导管中通入氧气的作用是_______ 。保持试剂的用量不变,实验中提高反应速率的操作有______ (写一种)。该步骤首先加入一定量 的
的 溶液,再调节浓
溶液,再调节浓 的用量至
的用量至 为2.0左右时,铜粉和浓
为2.0左右时,铜粉和浓 完全反应,主要反应的化学方程式为
完全反应,主要反应的化学方程式为_______ 。硝酸过量对产品的影响为______ 。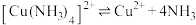 ;
; 、
、 难溶于乙醇。结合下图,
难溶于乙醇。结合下图,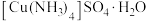 在乙醇—水混合液中的溶解度随乙醇体积分数变化曲线,将加入足量氨水后所得的
在乙醇—水混合液中的溶解度随乙醇体积分数变化曲线,将加入足量氨水后所得的 溶液制备
溶液制备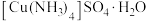 晶体的实验方案补充完整:将
晶体的实验方案补充完整:将 溶液加入
溶液加入______ ,所得沉淀先用乙醇—水混合液洗涤,向最后的洗涤滤液中滴加_______ (填试剂)无沉淀生成,再将晶体用无水乙醇洗涤,放入真空干燥箱中干燥。
 晶体和
晶体和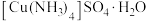 晶体,其实验流程如下:
晶体,其实验流程如下: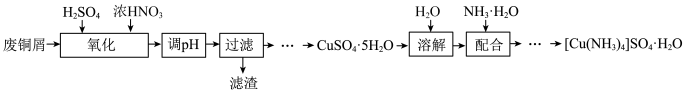
(1)基态Cu原子核外电子排布式为
(2)
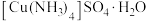 中,中心离子为
中,中心离子为(3)
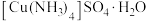 中,存在的化学键有
中,存在的化学键有a.离子键 b.非极性共价键 c.极性共价键 d.配位键 e.氢键
(4)“氧化”时,在如图所示的装置中进行。从长导管中通入氧气的作用是
 的
的 溶液,再调节浓
溶液,再调节浓 的用量至
的用量至 为2.0左右时,铜粉和浓
为2.0左右时,铜粉和浓 完全反应,主要反应的化学方程式为
完全反应,主要反应的化学方程式为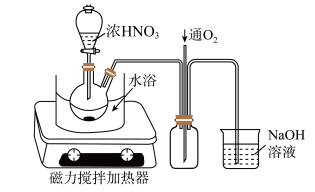
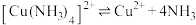 ;
; 、
、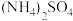 难溶于乙醇。结合下图,
难溶于乙醇。结合下图,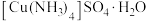 在乙醇—水混合液中的溶解度随乙醇体积分数变化曲线,将加入足量氨水后所得的
在乙醇—水混合液中的溶解度随乙醇体积分数变化曲线,将加入足量氨水后所得的 溶液制备
溶液制备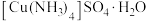 晶体的实验方案补充完整:将
晶体的实验方案补充完整:将 溶液加入
溶液加入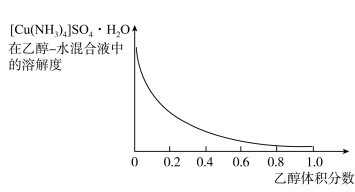
您最近半年使用:0次
解题方法
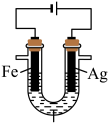
8 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制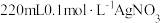 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: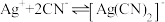 ,
,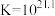 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是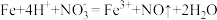 和
和___________ (用离子方程式表示,已知氧化性: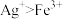 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中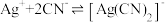 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为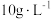 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为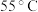 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由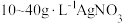 溶液和
溶液和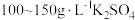 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: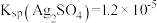 。
。
I.实验准备。
(1)用
 固体配制
固体配制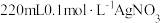 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
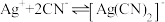 ,
,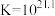 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
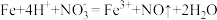 和
和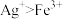 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
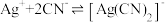 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(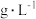 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为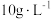 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
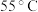 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
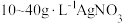 溶液和
溶液和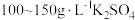 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
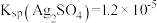 。
。
您最近半年使用:0次
7日内更新
|
125次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
9 . 由辉铜矿(含 ,少量
,少量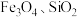 )合成
)合成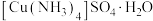 的流程如下。
的流程如下。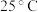 时,
时, ,
,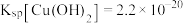 ,离子浓度
,离子浓度 时可认为离子完全沉淀。下列说法正确的是
时可认为离子完全沉淀。下列说法正确的是
 ,少量
,少量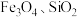 )合成
)合成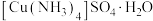 的流程如下。
的流程如下。
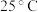 时,
时, ,
,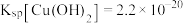 ,离子浓度
,离子浓度 时可认为离子完全沉淀。下列说法正确的是
时可认为离子完全沉淀。下列说法正确的是A.煅烧时只有 两种元素被氧化 两种元素被氧化 |
B.酸浸后,滤液的主要成分为 和 和 |
C.调 为 为 时,可实现铜、铁的分离 时,可实现铜、铁的分离 |
D. 乙醇的作用为增大 乙醇的作用为增大 的溶解度 的溶解度 |
您最近半年使用:0次
10 . 向AgBr饱和溶液(有足量AgBr固体)中滴加Na2S2O3溶液,发生反应Ag++
 [Ag(
[Ag( )]-和[Ag(
)]-和[Ag( )]-+
)]-+
 [Ag(
[Ag( )2]3-, lg[c(M)/(mol/L)、lgc(N)与lg[c(
)2]3-, lg[c(M)/(mol/L)、lgc(N)与lg[c( )/mol/L)的关系如下图所示(其中M代表Ag+或Br-;N代表
)/mol/L)的关系如下图所示(其中M代表Ag+或Br-;N代表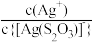 或
或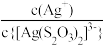 ):
):

 [Ag(
[Ag( )]-和[Ag(
)]-和[Ag( )]-+
)]-+
 [Ag(
[Ag( )2]3-, lg[c(M)/(mol/L)、lgc(N)与lg[c(
)2]3-, lg[c(M)/(mol/L)、lgc(N)与lg[c( )/mol/L)的关系如下图所示(其中M代表Ag+或Br-;N代表
)/mol/L)的关系如下图所示(其中M代表Ag+或Br-;N代表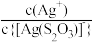 或
或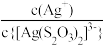 ):
):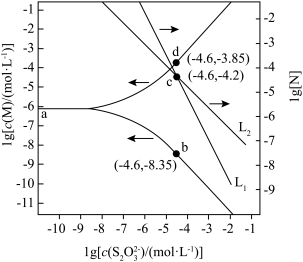
A.直线L1表示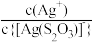 随 随 浓度变化的关系 浓度变化的关系 |
| B.AgBr的溶度积常数Ksp=c(Ag+)c(Br-)=10-12.2 |
C.反应AgBr+2  [Ag( [Ag( )2]3-+Br-的平衡常数K的值为101.2 )2]3-+Br-的平衡常数K的值为101.2 |
D.c( )= 0.001 mol/L时,溶液中c(Br-)>c{[Ag( )= 0.001 mol/L时,溶液中c(Br-)>c{[Ag( )2]3-}>c{[Ag(S2O3)]-} )2]3-}>c{[Ag(S2O3)]-} |
您最近半年使用:0次
7日内更新
|
315次组卷
|
2卷引用:河北省石家庄市2024届高三下学期4月第二次质检化学试题