名校
解题方法
1 . 分类是学化学的重要方法,下列分类正确的是
A.醇类: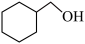 和 和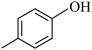 | B.电子云轮廓图为球形:2s、2p、3s |
| C.共价晶体:锗、硅和金刚石 | D.配合物: 和 和 |
您最近一年使用:0次
名校
解题方法
2 . 配合物在生产、生活中应用广泛。例如, (铁氰化钾)用于检验
(铁氰化钾)用于检验 ,
, 用于检验
用于检验 。回答下列问题:
。回答下列问题:
(1)基态 的价层电子排布式为
的价层电子排布式为___________ ,向某未知溶液中滴加适量 溶液,若
溶液,若___________ (填实验现象),则说明溶液中含有 。
。
(2) 中配位原子是
中配位原子是___________ (填元素符号)。
(3)已知:络合平衡反应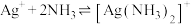 ,其平衡常数又称配离子稳定常数,
,其平衡常数又称配离子稳定常数,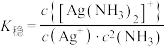 。常温下,
。常温下,
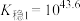 ;
;
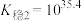 。
。
由此推知稳定性:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是___________ 。
(4)分裂能( )定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能(
)定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能( ):
):
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是___________ 。
 (铁氰化钾)用于检验
(铁氰化钾)用于检验 ,
, 用于检验
用于检验 。回答下列问题:
。回答下列问题:(1)基态
 的价层电子排布式为
的价层电子排布式为 溶液,若
溶液,若 。
。(2)
 中配位原子是
中配位原子是(3)已知:络合平衡反应
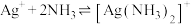 ,其平衡常数又称配离子稳定常数,
,其平衡常数又称配离子稳定常数,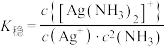 。常温下,
。常温下,
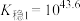 ;
;
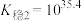 。
。由此推知稳定性:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是(4)分裂能(
 )定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能(
)定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能( ):
):
 (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是
您最近一年使用:0次
名校
解题方法
3 . A、B、C、D、E为前四周期原子序数依次增大的五种元素。其中A元素原子半径是所有元素原子中最小的,B元素原子核外有三种不同的能级且各个能级所填充的电子数相同,D元素原子最外层电子数是内层电子数的3倍,E2+的3d轨道中有10个电子。
(1)E基态原子的核外电子排布式为__________________ 。
(2)B、C、D三种元素电负性从小到大的顺序是______________ (填元素符号)。
(3)B2A2中的化学键包括_________ 键(填“极性键”或“非极性键”),分子为_________ 分子(填“极性”或“非极性”)。1mol B2A2分子中含有 键与
键与 键的数目之比为
键的数目之比为_________ 。
(4)A2D2是常用的绿色氧化剂,其电子式为___________ 。A2D2能与水混溶,却不溶于CCl4。请解释原因__________________ 。
(5)B、C形成的BC-常作为配位化合物的配体。已知E2+与 形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式_________________ 。
(1)E基态原子的核外电子排布式为
(2)B、C、D三种元素电负性从小到大的顺序是
(3)B2A2中的化学键包括
 键与
键与 键的数目之比为
键的数目之比为(4)A2D2是常用的绿色氧化剂,其电子式为
(5)B、C形成的BC-常作为配位化合物的配体。已知E2+与
 形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
您最近一年使用:0次
2024-05-02更新
|
63次组卷
|
2卷引用:广西百色市田东县''贵百河“2023-2024学年高二下学期4月月考化学试题
4 . 由下列实验方案、现象得出的结论不正确的是
实验方案 | 现象 | 结论 | |
| A | 向FeCl3溶液中加入几滴KSCN溶液 | 溶液立即变红 | KSCN溶液可用来检验Fe3+ |
| B | 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流 | 液流方向改变 | CF2Cl2是正四面体结构,为非极性分子 |
| C | 在碘水中加入CCl4,振荡 | 分层,下层紫红色 | I2在水中的溶解度小于在CCl4中的溶解度 |
| D | [Cu(NH3)4]SO4溶液中加入乙醇 | 析出深蓝色固体 | [Cu(NH3)4]SO4在乙醇中溶解度小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-22更新
|
153次组卷
|
2卷引用:广西百色市田东县''贵百河“2023-2024学年高二下学期4月月考化学试题
解题方法
5 . 硫酸四氨合铜晶体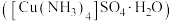 常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和
常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和 反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
一、硫酸四氨合铜的制备
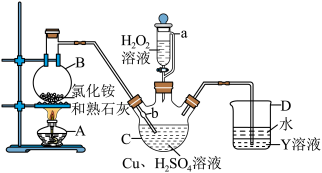
(1)仪器 的名称是
的名称是_____________ ;球泡 的作用是
的作用是_____________ ; 中的
中的 液体可以为
液体可以为_________ (填化学式)。
(2)装置 中得到深蓝色溶液的总反应的离子方程式为
中得到深蓝色溶液的总反应的离子方程式为______________________ 。
(3)反应后取下仪器甲,向其中缓缓加入 乙醇、抽滤、洗涤得到
乙醇、抽滤、洗涤得到 晶体,采用抽滤的原因是
晶体,采用抽滤的原因是______________________ 。
二、测定制备样品中氨的含量
步骤:按如图所示装置进行实验(药品及用量已标出;加热、夹持等装置已略去;硼酸极弱,仅作吸收剂,不影响盐酸标定氨的实验结果),维持沸腾一小时,取下锥形瓶,加入指示剂进行滴定操作,到达滴定终点时,消耗 的盐酸溶液
的盐酸溶液 。
。
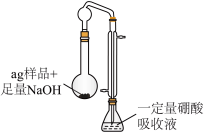
(4)指示剂为_____________ 。
(5)该晶体的纯度为_____________________  。
。
(6)下列实验操作可能使氨含量测定结果偏低的原因是 。
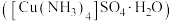 常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和
常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨,常温下在空气中易与水和 反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:
反应生成铜的碱式盐,变成绿色粉末。某学习小组在实验室中用如图的装置制备硫酸四氨合铜晶体并测定其纯度,请回答下列问题:一、硫酸四氨合铜的制备

(1)仪器
 的名称是
的名称是 的作用是
的作用是 中的
中的 液体可以为
液体可以为(2)装置
 中得到深蓝色溶液的总反应的离子方程式为
中得到深蓝色溶液的总反应的离子方程式为(3)反应后取下仪器甲,向其中缓缓加入
 乙醇、抽滤、洗涤得到
乙醇、抽滤、洗涤得到 晶体,采用抽滤的原因是
晶体,采用抽滤的原因是二、测定制备样品中氨的含量
步骤:按如图所示装置进行实验(药品及用量已标出;加热、夹持等装置已略去;硼酸极弱,仅作吸收剂,不影响盐酸标定氨的实验结果),维持沸腾一小时,取下锥形瓶,加入指示剂进行滴定操作,到达滴定终点时,消耗
 的盐酸溶液
的盐酸溶液 。
。
(4)指示剂为
(5)该晶体的纯度为
 。
。(6)下列实验操作可能使氨含量测定结果偏低的原因是 。
A.滴定时未用 标准溶液润洗滴定管 标准溶液润洗滴定管 | B.滴定前滴定管内无气泡,滴定后有气泡 |
| C.读数时,滴定前俯视,滴定后仰视 | D.刚看到指示剂局部的颜色变化就停止滴定 |
您最近一年使用:0次
6 . 下列说法错误的是
A.冠醚能识别 形成超分子,是因为 形成超分子,是因为 的直径与该冠醚空腔直径相当 的直径与该冠醚空腔直径相当 |
B. 与 与 形成配合物 形成配合物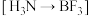 ,是因为 ,是因为 中的B有空轨道接受 中的B有空轨道接受 中N的孤电子对 中N的孤电子对 |
C. 的酸性强于 的酸性强于 ,是因为 ,是因为 的相对分子质量小于 的相对分子质量小于 |
D.自然界不存在稳定的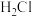 和 和 ,是因为共价键具有饱和性 ,是因为共价键具有饱和性 |
您最近一年使用:0次
名校
7 . 以Pd(NH3)2Cl2固体为原料制备纯PdCl2,其部分实验过程如图:
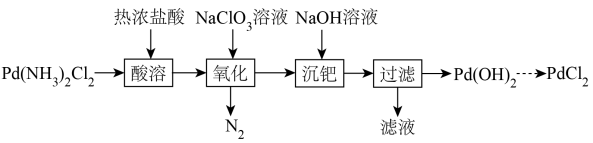
已知:①Pd(NH3)2Cl2+2HCl=(NH4)2[PdCl4];
②H2PdCl4+4NaOH=Pd(OH)2↓+4NaCl+2H2O;
③Pd(OH)2有两性,遇氨水会生成[Pd(NH3)4]2+。
(1)H2PdCl4为二元强酸,写出“氧化”时主要发生反应的离子方程式:________ 。
(2)“氧化”时易产生一种黄绿色的有毒气体,该气体的化学式为_______ 。
(3)若“氧化”不充分会导致“沉钯”时Pd(OH)2的产率降低,原因可能是_______ 。氧化液中Pd的浓度一定,为提高Pd(OH)2的产率,“沉钯”时需控制的条件有反应的温度、_______ 。
(4)在配合物Pd(NH3)2Cl2中,提供空轨道的元素为_______ 。
(5)CO可将PdCl2溶液还原得到金属Pd,同时产生一种温室气体,写出反应的化学方程式:________ 。标准状况下,1体积的钯粉大约可吸附896体积的氢气形成一种氢化物(钯粉的密度为10.64g•cm-3,Pd的相对原子质量为106.4),据此可知该种钯(Pd)的氢化物的化学式为________ 。若用H2代替CO还原PdCl2,消耗的H2质量比理论值略高,其原因是______ 。

已知:①Pd(NH3)2Cl2+2HCl=(NH4)2[PdCl4];
②H2PdCl4+4NaOH=Pd(OH)2↓+4NaCl+2H2O;
③Pd(OH)2有两性,遇氨水会生成[Pd(NH3)4]2+。
(1)H2PdCl4为二元强酸,写出“氧化”时主要发生反应的离子方程式:
(2)“氧化”时易产生一种黄绿色的有毒气体,该气体的化学式为
(3)若“氧化”不充分会导致“沉钯”时Pd(OH)2的产率降低,原因可能是
(4)在配合物Pd(NH3)2Cl2中,提供空轨道的元素为
(5)CO可将PdCl2溶液还原得到金属Pd,同时产生一种温室气体,写出反应的化学方程式:
您最近一年使用:0次
2023-10-24更新
|
67次组卷
|
2卷引用:广西壮族自治区桂林市等3地2023-2024学年高三上学期10月月考化学试题
23-24高三上·湖北武汉·阶段练习
名校
8 . 一水硫酸四氨合铜 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
Ⅰ.制备少量晶体 ,设计实验方案如下:
,设计实验方案如下:

(1)仪器A的名称为_____ ,对比铜和浓硫酸加热制备硫酸铜,该方案的优点是_____ 。
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是_____ 。
Ⅱ.氨含量的测定。精确称取 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10% 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
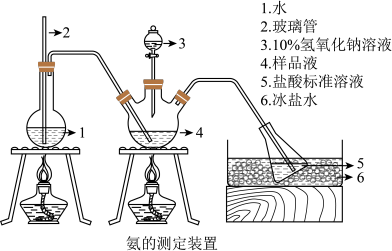
(3)“玻璃管2”的作用_____ ,样品中氨的质量分数的表达式_____ 。
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
(4)上述实验现象与配位离子的解离平衡有关,请用适当的化学用语表示该配位离子的解离平衡_____ ,则加入氢氧化钠溶液后的现象为_____ 。
 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题Ⅰ.制备少量晶体
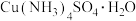 ,设计实验方案如下:
,设计实验方案如下:
(1)仪器A的名称为
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是
Ⅱ.氨含量的测定。精确称取
 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10% 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
(3)“玻璃管2”的作用
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1
 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:| 加入试剂 | 水 | 稀硫酸 | 氢氧化钠 |
| 现象 | 几乎无变化 | 溶液颜色变成浅蓝色,与同浓度硫酸铜颜色相当 |
您最近一年使用:0次
2023-08-16更新
|
265次组卷
|
3卷引用:化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升
(已下线)化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升湖北省武汉部分重点高中2023-2024学年高三上学期8月联考化学试题江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题
名校
9 . 已知:  。试管 a 中溶液作参照,对试管 b 中溶液依次进行如下操作:①微热,溶液变为黄绿色;②将其置于冷水中,溶液变为蓝绿色;③滴加氨水至过量,蓝色沉淀增多,后又逐渐消失变为深蓝色溶液。下列说法正确的是
。试管 a 中溶液作参照,对试管 b 中溶液依次进行如下操作:①微热,溶液变为黄绿色;②将其置于冷水中,溶液变为蓝绿色;③滴加氨水至过量,蓝色沉淀增多,后又逐渐消失变为深蓝色溶液。下列说法正确的是

 。试管 a 中溶液作参照,对试管 b 中溶液依次进行如下操作:①微热,溶液变为黄绿色;②将其置于冷水中,溶液变为蓝绿色;③滴加氨水至过量,蓝色沉淀增多,后又逐渐消失变为深蓝色溶液。下列说法正确的是
。试管 a 中溶液作参照,对试管 b 中溶液依次进行如下操作:①微热,溶液变为黄绿色;②将其置于冷水中,溶液变为蓝绿色;③滴加氨水至过量,蓝色沉淀增多,后又逐渐消失变为深蓝色溶液。下列说法正确的是
| A.由步骤①可推知该反应的△H< 0 |
| B.由步骤②可说明降低温度,该反应平衡正向移动 |
C.步骤③深蓝色溶液中 |
D.由实验③可知配离子的稳定性: |
您最近一年使用:0次
10 . 我国科学家开发了一种新型手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物( )作为G—quadruplexDNA稳定剂和端粒酶抑制剂。手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物的化学结构∆/A—RuPt和相关的单一核配合物(Pt和
)作为G—quadruplexDNA稳定剂和端粒酶抑制剂。手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物的化学结构∆/A—RuPt和相关的单一核配合物(Pt和 )的结构如图所示。已知:在等价轨道上的电子排布采取全充满和半充满时,能量会较低,体系有更大的稳定性。下列说法正确的是
)的结构如图所示。已知:在等价轨道上的电子排布采取全充满和半充满时,能量会较低,体系有更大的稳定性。下列说法正确的是
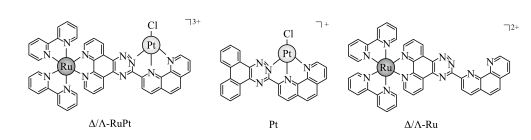
已知:Ru(Ⅱ)表示+2价Ru,Pt(Ⅱ)的配位数为4。
 )作为G—quadruplexDNA稳定剂和端粒酶抑制剂。手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物的化学结构∆/A—RuPt和相关的单一核配合物(Pt和
)作为G—quadruplexDNA稳定剂和端粒酶抑制剂。手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物的化学结构∆/A—RuPt和相关的单一核配合物(Pt和 )的结构如图所示。已知:在等价轨道上的电子排布采取全充满和半充满时,能量会较低,体系有更大的稳定性。下列说法正确的是
)的结构如图所示。已知:在等价轨道上的电子排布采取全充满和半充满时,能量会较低,体系有更大的稳定性。下列说法正确的是
已知:Ru(Ⅱ)表示+2价Ru,Pt(Ⅱ)的配位数为4。
A.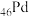 与 与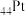 位于同一周期,基态Pd的价层电子排布式为 位于同一周期,基态Pd的价层电子排布式为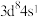 |
| B.单一核配合物Pt中的配位原子只有N原子 |
C. 中Ru原子与Pt原子的配位数相同 中Ru原子与Pt原子的配位数相同 |
D.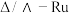 中Ru提供空轨道形成配位键 中Ru提供空轨道形成配位键 |
您最近一年使用:0次
2023-07-10更新
|
72次组卷
|
4卷引用:广西壮族自治区钦州市2022-2023学年高二下学期期末教学质量监测化学试题



