1 .  是一系列化合物,向含
是一系列化合物,向含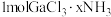 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示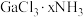 结构的化学式为
结构的化学式为_______ 。
 是一系列化合物,向含
是一系列化合物,向含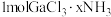 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示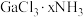 结构的化学式为
结构的化学式为
您最近一年使用:0次
2 . MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,Mn2+与NH3之间的化学键为什么键
| A.π键 | B.σ键 | C.配位键 | D.离子键 |
您最近一年使用:0次
2024·内蒙古锡林郭勒盟·三模
名校
解题方法
3 . 科技强国,我国科学家在诸多领域取得新突破。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂 、
、 及清洗剂
及清洗剂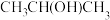 。
。
①基态F原子核外电子有_____ 种空间运动状态,下列为氟原子激发态的电子排布式的是_____ (填标号)。
A. B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为__________ 。
③氟硼酸铵( )中B的杂化方式为
)中B的杂化方式为__________ , 的空间构型为
的空间构型为__________ 。
(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是__________ (填元素符号),Mn原子的配位数为__________ ,CH3CN中 键与
键与 键数目之比为
键数目之比为__________ 。
(3)超导材料 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为__________ (列出计算式即可) 。
。
(1)芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。其中“刻蚀”过程可能用到刻蚀剂
 、
、 及清洗剂
及清洗剂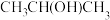 。
。①基态F原子核外电子有
A.
 B.
B. C.
C. D.
D.
②C、N、O、F四种元素的第一电离能由大到小的顺序为
③氟硼酸铵(
 )中B的杂化方式为
)中B的杂化方式为 的空间构型为
的空间构型为(2)复兴号高铁车体材质用到了Mn、Co等元素。Mn的一种配合物的化学式为[Mn(CO)5(CH3CN)],CH3CN与Mn原子配位时,提供孤电子对的是
 键与
键与 键数目之比为
键数目之比为(3)超导材料
 具有
具有 型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为
型结构(如图),晶胞参数(晶胞边长)为a pm,该氮化钛晶体的密度为 。
。
您最近一年使用:0次
2024-04-11更新
|
296次组卷
|
5卷引用:化学(上海卷03)-2024年高考押题预测卷
(已下线)化学(上海卷03)-2024年高考押题预测卷2024届内蒙古锡林郭勒盟高三第三次模拟考试理综试卷-高中化学2024届青海省部分学校高三下学期模拟考试理综试题-高中化学2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学(已下线)T16-结构与性质
4 . 铜及其化合物在生产和生活中有着广泛的应用。
(1)Cu在元素周期表中的位置为______ 。
(2)基态铜原子有______ 种运动状态不同的电子。
(3)原子核外电子的两种自旋状态分别用+ 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为______ 。
(4)Cu+比Cu2+更稳定的原因是_______ 。
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
(5)步骤I中反应的离子方程式为________ ;_______ 。
(6)H-N-H键角大小:[Cu(NH3)4]2+_______ NH3(填“>”、“=”或“<”),其原因是_______ 。
(7)该实验能说明,Cu2+与NH3的结合能力_______ (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力。
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是______ 。
(1)Cu在元素周期表中的位置为
(2)基态铜原子有
(3)原子核外电子的两种自旋状态分别用+
 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为(4)Cu+比Cu2+更稳定的原因是
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
| 序号 | 实验步骤 | 实验现象或结论 |
| I | 向CuSO4溶液中逐滴加入氨水至过量 | 产生蓝色沉淀,随后溶解并得到深蓝色的溶液 |
| Ⅱ | 再加入无水乙醇 | 得到深蓝色晶体 |
| Ⅲ | 测定深蓝色晶体的结构 | 晶体的化学式为[Cu(NH3)4]SO4 H2O H2O |
| Ⅳ | 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 | 无蓝色沉淀生成 |
(5)步骤I中反应的离子方程式为
(6)H-N-H键角大小:[Cu(NH3)4]2+
(7)该实验能说明,Cu2+与NH3的结合能力
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是
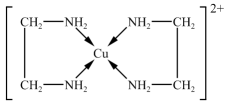
| A.该离子的配位数是4 |
| B.该离子的配体数是4 |
| C.形成配离子前后,Cu的化合价不变 |
| D.该离子中含有离子键、非极性键与极性键 |
您最近一年使用:0次
名校
解题方法
5 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是___________ (用离子方程式表示),溶液中离子浓度由大到小的顺序为___________ 。
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:
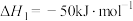
反应ⅱ:
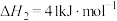
①CO(g)和H2(g)合成甲醇的热化学方程式为___________ ;该反应达平衡后,若升高温度,平衡___________ 移动。
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是___________ 。
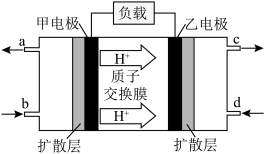
A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为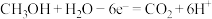
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。
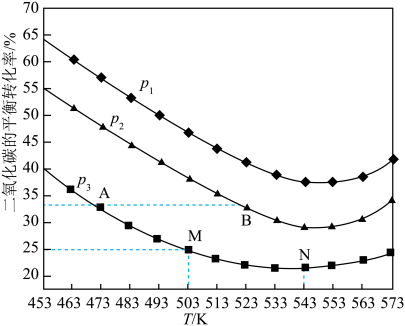
①压强p1、p2、p3由小到大的顺序为___________ 。
②A点、M点的化学反应速率大小: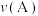
___________ 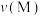 。
。
A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是___________ 。
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为___________ 。(CO的选择性 )。
)。
(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度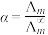 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,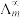 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,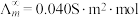 (
(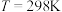 )。实验测得
)。实验测得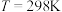 时,
时, 乙酸的
乙酸的 。该条件下测定的乙酸的电离度为
。该条件下测定的乙酸的电离度为___________ %;乙酸的电离平衡常数 为
为___________ (计算结果保留2位有效数字)。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:

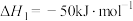
反应ⅱ:

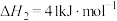
①CO(g)和H2(g)合成甲醇的热化学方程式为
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是

A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为
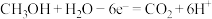
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。

①压强p1、p2、p3由小到大的顺序为
②A点、M点的化学反应速率大小:
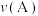
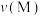 。
。A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为
 )。
)。(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

| A.CO2在反应中断裂极性键 |
B.总反应方程式为H2+ +CO2 +CO2 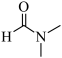 +H2O +H2O |
| C.配合物C中的配位键由Ir提供孤电子对 |
| D.最后一步生成DMF的反应类型为氧化反应 |
(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
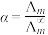 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,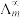 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,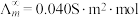 (
(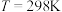 )。实验测得
)。实验测得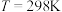 时,
时, 乙酸的
乙酸的 。该条件下测定的乙酸的电离度为
。该条件下测定的乙酸的电离度为 为
为
您最近一年使用:0次
6 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3)。其制备流程如图所示:
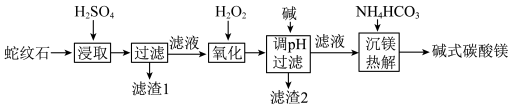
(1)①滤渣1的主要成分从性质上来分,属于___________ 氧化物,其用途很广泛,请写出一种:___________ 。
A.酸性 B.两性 C.碱性
②如图表示该物质晶体的晶胞结构,1个该晶胞中含有___________ 个A-B键。
A.28 B.32 C.36
(2)a.滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①氧化产物Fe3+可以作H2O2分解的催化剂,加快H2O2的分解速率、②___________ 。
b.酸性KMnO4溶液是否可以检验“氧化”过程已完全___________ ?并说明理由___________ 。
A.是 B.否
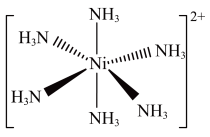
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有___________ 种。
A.1 B.2 C.4
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镤(MgCO3·3H2O)和CO2,第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:___________ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为ag/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为___________ ×100%(用含x、y、a、b的式子表示)。

(1)①滤渣1的主要成分从性质上来分,属于
A.酸性 B.两性 C.碱性
②如图表示该物质晶体的晶胞结构,1个该晶胞中含有
A.28 B.32 C.36

(2)a.滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①氧化产物Fe3+可以作H2O2分解的催化剂,加快H2O2的分解速率、②
b.酸性KMnO4溶液是否可以检验“氧化”过程已完全
A.是 B.否
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有
A.1 B.2 C.4

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镤(MgCO3·3H2O)和CO2,第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为ag/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
名校
解题方法
7 . 铁、钴、镍并称铁系元素,性质具有相似性。
(1)基态钴原子的核外电子排布式为___________ ,Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ 。
(2)铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数目为___________ ,与CN-互为等电子体(化学通式相同且价电子总数相等)的分子有___________ ,铁氰化钾晶体中各种微粒间的相互作用不包括___________ 。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为___________ ,碳原子的杂化类型为___________ 。
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO___________ FeO(填“<”或“>”),判断依据是___________ 。
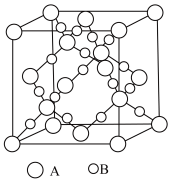
(5)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________ ,该化合物的化学式为___________ 。

(1)基态钴原子的核外电子排布式为
(2)铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数目为
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(5)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是

您最近一年使用:0次
8 . 白色硫酸铜粉末溶于水,溶液显________ 色,加入NaOH溶液出现________ ,继续滴加氨水,现象是_______ ,过渡金属原子一般易形成配合物,原因是______ ,乙二胺(H2NCH2CH2NH2)与铜、镁均可形成配合物,其中与_______ (填“铜”或“镁”)形成的配合物更稳定。
您最近一年使用:0次
9 . O元素可与 素形成低价态氧化物
素形成低价态氧化物 。
。
(1) 立方晶胞结构如图所示,则
立方晶胞结构如图所示,则 的配位数为___________。
的配位数为___________。
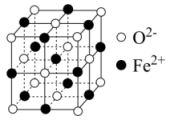
(2)与 紧邻的所有
紧邻的所有 构成的几何构型为___________。
构成的几何构型为___________。
(3) 晶胞边长为
晶胞边长为 ,则该晶体的密度为
,则该晶体的密度为___________  。(用含a、
。(用含a、 的代数式表示,
的代数式表示, 代表阿伏伽德罗常数的值)
代表阿伏伽德罗常数的值)
 素形成低价态氧化物
素形成低价态氧化物 。
。(1)
 立方晶胞结构如图所示,则
立方晶胞结构如图所示,则 的配位数为___________。
的配位数为___________。
| A.3 | B.4 | C.5 | D.6 |
 紧邻的所有
紧邻的所有 构成的几何构型为___________。
构成的几何构型为___________。| A.平面三角形 | B.正四面体 | C.立方体 | D.正八面体 |
 晶胞边长为
晶胞边长为 ,则该晶体的密度为
,则该晶体的密度为 。(用含a、
。(用含a、 的代数式表示,
的代数式表示, 代表阿伏伽德罗常数的值)
代表阿伏伽德罗常数的值)
您最近一年使用:0次
10 . 镓、锗是重要的半导体材料。中国是全球最大的镓、锗生产国,也是最大的出口国。2022年,中国镓产量占全球的98%、精炼锗产量占全球68%。
(1)基态镓 原子核外价电子的轨道表示式为
原子核外价电子的轨道表示式为______ ;同周期主族元素基态原子与其具有相同数目未成对电子的有______ (填元素符号)。
(2)按照核外电子的排布,可将元素周期表划分为4个区,Ge属于______。
(3)用原子光谱分析法可以确定元素种类。Ge元素的光谱不可能是______。
(4)与镓同族元素硼可以形成一系列的硼氢化合物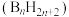 称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是
称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是______ 。
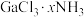 (
( ,4,5,6)是一系列化合物,向含
,4,5,6)是一系列化合物,向含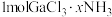 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为
氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为 。
。
(5) 分子的空间结构是三角锥形,
分子的空间结构是三角锥形, 的价层电子对的空间结构为______。
的价层电子对的空间结构为______。
(6)固态 晶体中含有的作用力有______。
晶体中含有的作用力有______。
(7)能准确表示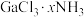 结构的化学式为
结构的化学式为______ 。
纳米材料是指在三维空间中至少有一维处于纳米尺寸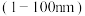 或由它们作为基本单元构成的材料。
或由它们作为基本单元构成的材料。
(8)一种纳米线的制备中使用到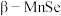 ,
,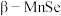 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。
① 中距
中距 最近的
最近的 有
有______ 个。
②若该晶体的晶胞边长为 ,阿伏加德罗常数为
,阿伏加德罗常数为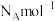 ,则
,则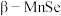 的密度为
的密度为______ (列出表达式) 。
。
(1)基态镓
 原子核外价电子的轨道表示式为
原子核外价电子的轨道表示式为(2)按照核外电子的排布,可将元素周期表划分为4个区,Ge属于______。
| A.s区 | B.p区 | C.d区 | D.f区 |
(3)用原子光谱分析法可以确定元素种类。Ge元素的光谱不可能是______。
| A.发射光谱 | B.吸收光谱 | C.线光谱 | D.连续光谱 |
(4)与镓同族元素硼可以形成一系列的硼氢化合物
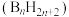 称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是
称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是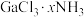 (
( ,4,5,6)是一系列化合物,向含
,4,5,6)是一系列化合物,向含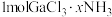 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为
氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为 。
。(5)
 分子的空间结构是三角锥形,
分子的空间结构是三角锥形, 的价层电子对的空间结构为______。
的价层电子对的空间结构为______。| A.直线形 | B.平面三角形 | C.三角锥形 | D.四面体形 |
(6)固态
 晶体中含有的作用力有______。
晶体中含有的作用力有______。| A.非极性键 | B.极性键 | C.配位键 | D.氢键 |
(7)能准确表示
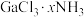 结构的化学式为
结构的化学式为纳米材料是指在三维空间中至少有一维处于纳米尺寸
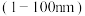 或由它们作为基本单元构成的材料。
或由它们作为基本单元构成的材料。(8)一种纳米线的制备中使用到
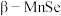 ,
,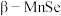 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。
①
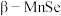 中距
中距 最近的
最近的 有
有②若该晶体的晶胞边长为
 ,阿伏加德罗常数为
,阿伏加德罗常数为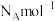 ,则
,则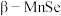 的密度为
的密度为 。
。
您最近一年使用:0次
2023-12-11更新
|
194次组卷
|
2卷引用:上海市建平中学2023-2024学年高三上学期期中教学质量检测化学试题



