名校
1 . 下列方程式书写正确的是
A.向氢氧化钡溶液中逐滴加入稀硫酸: |
B.实验室制备乙炔: |
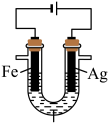
C.铜片与稀硝酸反应产生无色气泡: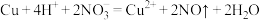 |
D.向氢氧化铜浊液中加入足量氨水得深蓝色溶液: |
您最近一年使用:0次
2024-05-06更新
|
134次组卷
|
2卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期5月期中考试化学试题
名校
解题方法
2 . A、B、C、D、E为前四周期原子序数依次增大的五种元素。其中A元素原子半径是所有元素原子中最小的,B元素原子核外有三种不同的能级且各个能级所填充的电子数相同,D元素原子最外层电子数是内层电子数的3倍,E2+的3d轨道中有10个电子。
(1)E基态原子的核外电子排布式为__________________ 。
(2)B、C、D三种元素电负性从小到大的顺序是______________ (填元素符号)。
(3)B2A2中的化学键包括_________ 键(填“极性键”或“非极性键”),分子为_________ 分子(填“极性”或“非极性”)。1mol B2A2分子中含有 键与
键与 键的数目之比为
键的数目之比为_________ 。
(4)A2D2是常用的绿色氧化剂,其电子式为___________ 。A2D2能与水混溶,却不溶于CCl4。请解释原因__________________ 。
(5)B、C形成的BC-常作为配位化合物的配体。已知E2+与 形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式_________________ 。
(1)E基态原子的核外电子排布式为
(2)B、C、D三种元素电负性从小到大的顺序是
(3)B2A2中的化学键包括
 键与
键与 键的数目之比为
键的数目之比为(4)A2D2是常用的绿色氧化剂,其电子式为
(5)B、C形成的BC-常作为配位化合物的配体。已知E2+与
 形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
形成配离子时,配位数为4,而Au+与BC-形成配离子时,配位数为2。工业上常用Au+与BC-形成的配离子与E单质反应,生成E2+与BC-形成的配离子来提取Au。写出上述离子反应的离子方程式
您最近一年使用:0次
2024-05-02更新
|
64次组卷
|
2卷引用:陕西省汉中市洋县中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
3 . 下列叙述中正确的有句
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
| A.2句 | B.3句 | C.4句 | D.5句 |
您最近一年使用:0次
2024-05-02更新
|
119次组卷
|
2卷引用:陕西省汉中市洋县中学2023-2024学年高二下学期期中考试化学试题
解题方法
4 . 向一定浓度硝酸银溶液中加入 溶液,产生
溶液,产生 沉淀,若加入过量
沉淀,若加入过量 溶液,沉淀会逐渐溶解,同时溶液中产生
溶液,沉淀会逐渐溶解,同时溶液中产生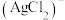 。溶液中含
。溶液中含 离子[
离子[ 和
和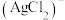 ]和
]和 的浓度关系如图所示[已知
的浓度关系如图所示[已知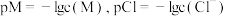 ],下列说法错误的是
],下列说法错误的是
 溶液,产生
溶液,产生 沉淀,若加入过量
沉淀,若加入过量 溶液,沉淀会逐渐溶解,同时溶液中产生
溶液,沉淀会逐渐溶解,同时溶液中产生 。溶液中含
。溶液中含 离子[
离子[ 和
和 ]和
]和 的浓度关系如图所示[已知
的浓度关系如图所示[已知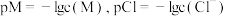 ],下列说法错误的是
],下列说法错误的是
A.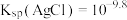 |
B.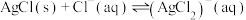 的 的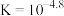 |
C.随着 溶液的加入, 溶液的加入,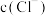 先升高后降低 先升高后降低 |
D. 点时溶液中存在: 点时溶液中存在: |
您最近一年使用:0次
解题方法
5 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制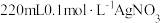 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: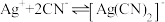 ,
,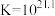 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是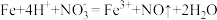 和
和___________ (用离子方程式表示,已知氧化性: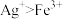 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中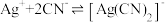 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为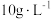 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由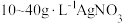 溶液和
溶液和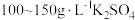 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: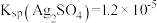 。
。
I.实验准备。
(1)用
 固体配制
固体配制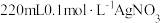 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
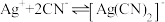 ,
,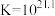 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的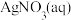 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
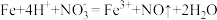 和
和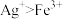 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
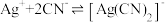 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(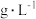 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为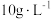 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
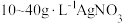 溶液和
溶液和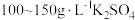 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
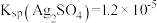 。
。
您最近一年使用:0次
2024-04-16更新
|
302次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
6 . 将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl- [CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下:
[CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下:
下列结论和解释正确的是
 [CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下:
[CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下: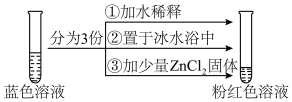
下列结论和解释正确的是
| A.[Co(H2O)6]2+配位数为6,中心离子为Co2+,配位原子为H |
| B.由实验①可知平衡逆向移动 |
| C.由实验②可推知ΔH<0 |
| D.由实验③可知配离子的稳定性:[ZnCl4]2-< [CoCl4]2- |
您最近一年使用:0次
2024-04-05更新
|
50次组卷
|
2卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期5月期中考试化学试题
解题方法
7 . 铋酸钠( ,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为
,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为 ,含
,含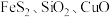 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
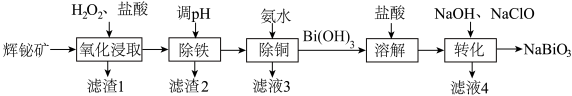
已知:“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质。回答下列问题:
,硫元素转化为硫单质。回答下列问题:
(1) 中铋元素的化合价为
中铋元素的化合价为___________ 价;“氧化浸取”时温度不能过高的原因是___________ ;“氧化浸取”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)“滤渣1”的主要成分为硫单质和___________ (写化学式)。
(3)“除铜”时,发生反应 ,该反应的平衡常数
,该反应的平衡常数
___________ 。{已知
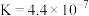 }
}
(4)在酸性介质中, 可将
可将 氧化为
氧化为 ,反应后
,反应后 元素呈
元素呈 价,则向足量稀硫酸和
价,则向足量稀硫酸和 稀溶液的混合溶液中加入
稀溶液的混合溶液中加入 时,反应中n(氧化剂):n(还原剂)=
时,反应中n(氧化剂):n(还原剂)=___________ 。
(5)“转化”时生成 反应的离子方程式为
反应的离子方程式为___________ 。
 ,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为
,难溶于水)是一种新型光催化剂,也被广泛应用于制药业。以辉铋矿(主要成分为 ,含
,含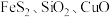 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
已知:“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质。回答下列问题:
,硫元素转化为硫单质。回答下列问题:(1)
 中铋元素的化合价为
中铋元素的化合价为 发生反应的化学方程式为
发生反应的化学方程式为(2)“滤渣1”的主要成分为硫单质和
(3)“除铜”时,发生反应
 ,该反应的平衡常数
,该反应的平衡常数

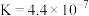 }
}(4)在酸性介质中,
 可将
可将 氧化为
氧化为 ,反应后
,反应后 元素呈
元素呈 价,则向足量稀硫酸和
价,则向足量稀硫酸和 稀溶液的混合溶液中加入
稀溶液的混合溶液中加入 时,反应中n(氧化剂):n(还原剂)=
时,反应中n(氧化剂):n(还原剂)=(5)“转化”时生成
 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 黄金除具备货币商品属性外,由于其优良特性,还可用作珠宝装饰、金触媒、超导体等。以含砷金精矿(成分为Au、FeAsS)为原料提炼黄金的工艺流程如图,请回答下列问题:______ 。
(2)焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为______ ℃,原因为______ 。______ 。
(4)氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:______ 。
(5)滤渣的主要成分为______ 、______ 。
(6)at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得______ tAu。

(2)焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为
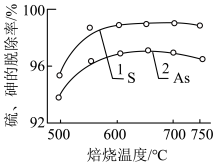
(4)氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:
(5)滤渣的主要成分为
(6)at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得
您最近一年使用:0次
2024-03-19更新
|
247次组卷
|
2卷引用:2024届陕西省西安市浐灞第二中学高三下学期理科综合模拟试卷-高中化学
名校
9 . EDTA(乙二胺四乙酸)可用于水的软化,软化水过程中与 形成的一种配合物如图所示。下列说法错误的是
形成的一种配合物如图所示。下列说法错误的是
 形成的一种配合物如图所示。下列说法错误的是
形成的一种配合物如图所示。下列说法错误的是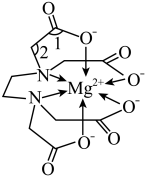
A.配合物中碳原子的杂化方式为 和 和 |
| B.图中键角1小于键角2 |
C.两种不同状态的镁,电离最外层一个电子所需能量: 大于 大于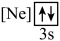 |
| D.1mol该配合物中的配位键有6mol |
您最近一年使用:0次
2024-02-23更新
|
355次组卷
|
3卷引用:陕西省西安市第八十三中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
10 . 向盛有少量蒸馏水的试管里滴加2滴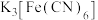 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。
下列说法正确的是
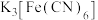 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。下列说法正确的是
| A.溶液颜色由黄色变为红色 |
B. 中由 中由 提供孤电子对, 提供孤电子对, 提供空轨道 提供空轨道 |
C. 和 和 与 与 的配位能力: 的配位能力: |
D. 中含 中含 键的物质的量为 键的物质的量为 |
您最近一年使用:0次
2024-02-16更新
|
248次组卷
|
2卷引用:陕西省西安市第八十三中学2023-2024学年高二下学期第一次月考化学试题