名校
解题方法
1 . 某实验小组探究 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。
【实验i】探究 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略) 的
的 溶液
溶液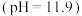 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。
(1)试剂a是_______ 。
(2)向 溶液中通入
溶液中通入 的目的可能是
的目的可能是_______ 。
(3) 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为_______ 。
(4)同学甲在 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由_______ 。
【实验ⅱ和实验ⅲ】探究 的性质
的性质_______ 。
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为_______ 。
【实验ⅳ】探究的应用
(7)将 溶于乳酸
溶于乳酸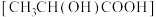 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是_______ 。
 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。【实验i】探究
 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略)
 的
的 溶液
溶液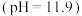 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。(1)试剂a是
(2)向
 溶液中通入
溶液中通入 的目的可能是
的目的可能是(3)
 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为(4)同学甲在
 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由【实验ⅱ和实验ⅲ】探究
 的性质
的性质
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为
【实验ⅳ】探究的应用
(7)将
 溶于乳酸
溶于乳酸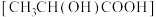 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是
您最近一年使用:0次
名校
2 . 硫酸四氨合铜晶体{[Cu(NH3)4]SO4∙H2O}在工业上用途广泛,常温下该物质在空气中不稳定,受热时易发生分解。现以铜粉、3mol/L的硫酸、浓氨水、10%NaOH溶液、95%的乙醇溶液、0.500mol/L稀盐酸、0.500mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(已知:CuSO4在水中的溶解度随温度的升高而增大。)
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为___________ 。
(2)第③步中,趁热过滤的目的是___________ 。
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作___________ 。
(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:___________ ,此处不采用浓缩结晶的原因是___________ 。
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。___________ 。
(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用___________ (填“酚酞”或“甲基橙”)作指示剂。
(7)样品中氨的质量分数的表达式为___________ (用含w、V1、V2的代数式表式)。
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为
(2)第③步中,趁热过滤的目的是
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作

(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用
(7)样品中氨的质量分数的表达式为
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
| A.滴定时未用NaOH标准溶液润洗滴定管 |
| B.读数时,滴定前平视,滴定后俯视 |
| C.将样品液中的氨全部蒸出后,未用蒸馏水冲洗导管内壁 |
| D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁 |
您最近一年使用:0次
名校
3 . 铜、钛、钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的价电子轨道表示式为___________ ,未成对电子数为___________ 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。与 互为等电子体的阳离子的化学式为
互为等电子体的阳离子的化学式为___________ 。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。___________ (填碳原子旁标的序号)。
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___________ 。根据价电子对互斥理论,预测[Co(NH3)4(H2O)2]2+的立体构型为___________ 体(填相关的立体构型)。
(5)我们通过学习,已经了解到Fe3+溶液在不同溶液中会显示不同的颜色,例如:[Fe(H2O)6]3+溶液显浅紫色(接近无色,肉眼几乎看不见浅紫色);[FeCl4(H2O)2]-溶液显黄色,[Fe(H2O)6-n(OH)n]3-n溶液显黄色。
已知Fe3+溶液存在以下平衡:
[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6-n(OH)n]3-n+nH3O+(正向为Fe3+水解)
[Fe(H2O)6]3++4Cl-⇌[FeCl4(H2O)2]-+4H2O请用上述平衡预测:
若两只盛有等量的Fe(NO3)3固体的试管,向第一只试管加1mL水,向第二只试管加1mL1mol/L稀硝酸,第一只试管发生的现象是___________ ,第二只试管发生的现象是___________ 。
(6)铜与类卤素(SCN)2反应生成Cu(SCN)2,HSCN结构有两种,分别是硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),沸点高的是___________ ,沸点高的原因是:___________ 。
(7)NH4HF2中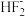 的结构为F-H…F-,则NH4HF2中含有的化学键有
的结构为F-H…F-,则NH4HF2中含有的化学键有___________ (填标号)。
A.氢键 B.价键 C.金属键 D.离子键 E.配位键
(1)钴元素基态原子的价电子轨道表示式为
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。与
 互为等电子体的阳离子的化学式为
互为等电子体的阳离子的化学式为(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为
(5)我们通过学习,已经了解到Fe3+溶液在不同溶液中会显示不同的颜色,例如:[Fe(H2O)6]3+溶液显浅紫色(接近无色,肉眼几乎看不见浅紫色);[FeCl4(H2O)2]-溶液显黄色,[Fe(H2O)6-n(OH)n]3-n溶液显黄色。
已知Fe3+溶液存在以下平衡:
[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6-n(OH)n]3-n+nH3O+(正向为Fe3+水解)
[Fe(H2O)6]3++4Cl-⇌[FeCl4(H2O)2]-+4H2O请用上述平衡预测:
若两只盛有等量的Fe(NO3)3固体的试管,向第一只试管加1mL水,向第二只试管加1mL1mol/L稀硝酸,第一只试管发生的现象是
(6)铜与类卤素(SCN)2反应生成Cu(SCN)2,HSCN结构有两种,分别是硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),沸点高的是
(7)NH4HF2中
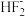 的结构为F-H…F-,则NH4HF2中含有的化学键有
的结构为F-H…F-,则NH4HF2中含有的化学键有A.氢键 B.价键 C.金属键 D.离子键 E.配位键
您最近一年使用:0次
4 . 盐酸氯丙嗪是一种多巴胺受体的阻断剂,临床有多种用途。化合物 是盐酸氯丙嗪制备的原料,可由化合物
是盐酸氯丙嗪制备的原料,可由化合物 和
和 在铜作催化剂条件下反应制得。
在铜作催化剂条件下反应制得。___________ 。
(2)1mol化合物 分子中含有σ键数目为
分子中含有σ键数目为___________ 。
(3)化合物 分子中sp3方式杂化的原子数目是
分子中sp3方式杂化的原子数目是___________ 。
(4)已知[Cu(NH3)4]SO4中[Cu(NH3)4]2+具有对称的空间构型,且当两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ (填序号)。
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)已知在[Cu(NH3)4]SO4中溶液中加入少量NiSO4,会立即转化为[Ni(NH3)6]SO4中,由此可知Ni2+与NH3之间形成的化学键键能___________ (填“大于”或“小于”)Cu2+与NH3之间形成的化学键键能。[Cu(NH3)4]2+中存在的化学键类型有___________ 。
 是盐酸氯丙嗪制备的原料,可由化合物
是盐酸氯丙嗪制备的原料,可由化合物 和
和 在铜作催化剂条件下反应制得。
在铜作催化剂条件下反应制得。 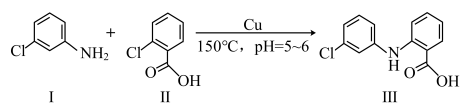
(2)1mol化合物
 分子中含有σ键数目为
分子中含有σ键数目为(3)化合物
 分子中sp3方式杂化的原子数目是
分子中sp3方式杂化的原子数目是(4)已知[Cu(NH3)4]SO4中[Cu(NH3)4]2+具有对称的空间构型,且当两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)已知在[Cu(NH3)4]SO4中溶液中加入少量NiSO4,会立即转化为[Ni(NH3)6]SO4中,由此可知Ni2+与NH3之间形成的化学键键能
您最近一年使用:0次
5 . 铁及其化合物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)1mol基态铁原子中未成对的电子数为___________ 。
(2)铁的常见氧化物中氧化铁比氧化亚铁稳定,试从原子结构角度解释原因:___________ 。
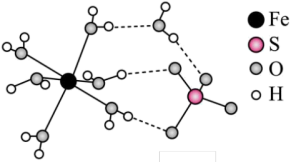
(3)铁作为过渡金属,能形成多种配位化合物。赤血盐{K3[Fe(CN)6]}为红色晶体,其配离子中提供空轨道的为___________ (填微粒符号),配位原子是___________ (填元素符号);Fe2+与1,10-邻二氮菲(phen)在水溶液中能形成稳定的螯合物,其结构如图,该螯合物中各元素的电负性由大到小的顺序为___________ ,N的杂化方式为___________ ,Fe2+的配位数为___________ 。
(1)1mol基态铁原子中未成对的电子数为
(2)铁的常见氧化物中氧化铁比氧化亚铁稳定,试从原子结构角度解释原因:
(3)铁作为过渡金属,能形成多种配位化合物。赤血盐{K3[Fe(CN)6]}为红色晶体,其配离子中提供空轨道的为

您最近一年使用:0次
名校
解题方法
6 .  的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 等形成配离子使溶液显色.如:显浅紫色的
等形成配离子使溶液显色.如:显浅紫色的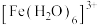 、红色的
、红色的 、黄色的
、黄色的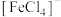 、无色的
、无色的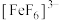 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验: 与
与 在溶液中存在以下平衡:
在溶液中存在以下平衡:
 。
。
下列说法不正确的是
 的配位化合物较稳定且运用广泛。它可与
的配位化合物较稳定且运用广泛。它可与 等形成配离子使溶液显色.如:显浅紫色的
等形成配离子使溶液显色.如:显浅紫色的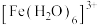 、红色的
、红色的 、黄色的
、黄色的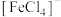 、无色的
、无色的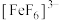 。某同学按如下步骤完成实验:
。某同学按如下步骤完成实验:
 与
与 在溶液中存在以下平衡:
在溶液中存在以下平衡:
 。
。下列说法不正确的是
A.Ⅰ中溶液呈黄色可能是由 水解产物的颜色引起的 水解产物的颜色引起的 |
B. 与 与 的配位能力强于 的配位能力强于 |
C.为了能观察到溶液Ⅰ中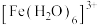 的颜色,可向该溶液中加入稀盐酸 的颜色,可向该溶液中加入稀盐酸 |
| D.向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色 |
您最近一年使用:0次
名校
解题方法
7 . 由硫铁矿烧渣(主要含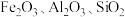 )制取绿矾
)制取绿矾 的流程如下:
的流程如下:
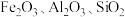 )制取绿矾
)制取绿矾 的流程如下:
的流程如下: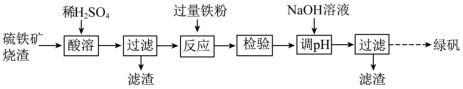
A.“检验”时可用 溶液检验上一步“反应”是否进行完全 溶液检验上一步“反应”是否进行完全 |
| B.将第二次“过滤”所得滤液加热,经蒸发结晶可以制得绿矾 |
C.绿矶中 为配体,中心离子的配位数为7 为配体,中心离子的配位数为7 |
| D.绿矾中存在共价键、配位键、氢键、离子键 |
您最近一年使用:0次
8 . 某物质 A 的实验式为CoCl3·4NH3, 1molA 中加入足量的 AgNO3溶液中能生成1mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中不正确的是
| A.Co3+与NH3、Cl-形成配位键 | B.配合物配位数为6 |
| C.该配合物可能是平面正方形结构 | D.此配合物可写成[Co (NH3) 4Cl2]Cl |
您最近一年使用:0次
名校
9 .  的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 、
、 、
、 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的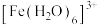 、红色的
、红色的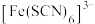 、无色的
、无色的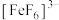 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法错误的是
形成配位离子。下列说法错误的是
 的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 、
、 、
、 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的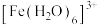 、红色的
、红色的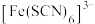 、无色的
、无色的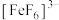 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: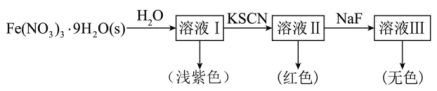
 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法错误的是
形成配位离子。下列说法错误的是| A.Fe晶体中原子通过金属阳离子和自由电子间的静电作用相结合 |
B.可用NaF和KSCN溶液检验 溶液中是否含有 溶液中是否含有 |
C.溶液Ⅰ中 仅参与形成范德华力和氢键 仅参与形成范德华力和氢键 |
D.上述实验可得出,与 形成配合物的能力: 形成配合物的能力: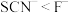 |
您最近一年使用:0次
2024-04-22更新
|
217次组卷
|
3卷引用:福建省宁德市福安市第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
10 . 下列示意图或图示正确的是
A.基态铬原子的价层电子轨道表示式为: |
B.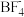 的结构式 的结构式 |
C.HF分子间的氢键 |
D.铁原子结构示意图 |
您最近一年使用:0次



