1 . 砷化镓是一种高性能半导体材料,被广泛应用于光电子器件等领域。砷化镓立方晶胞(晶胞参数为 )如图1。下列说法正确的是
)如图1。下列说法正确的是
 )如图1。下列说法正确的是
)如图1。下列说法正确的是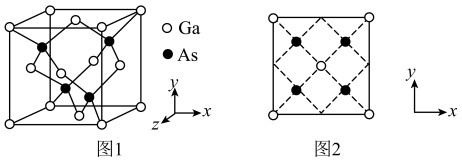
A. 的配位数为2 的配位数为2 | B.该晶胞沿z轴方向的平面投影如图2 |
| C.晶体中配位键占共价键总数的25% | D.晶胞中砷原子与镓原子间的最短距离为 |
您最近一年使用:0次
昨日更新
|
524次组卷
|
4卷引用:江西省南昌市八一中学2024届高三下学期三模测试化学试题
2 . 实验装置为实验提供必要条件和测量手段。如图装置不能达到实验目的的是
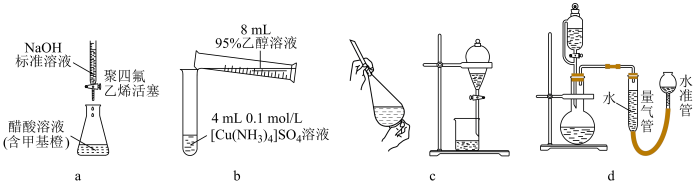
| A.图a测定醋酸溶液的浓度 |
| B.图b制备[Cu(NH3)4]SO4•H2O晶体 |
| C.图c用NaOH溶液除去溴苯中的溴单质 |
| D.图d测定一定质量的Na2O2和Na2O混合物中Na2O2的含量 |
您最近一年使用:0次
7日内更新
|
544次组卷
|
3卷引用:2024届江西省吉安市第一中学高三下学期三模化学试题
3 . 哲学中“量变引起质变”规律在化学上有广泛应用。下列各组物质之间的化学反应不遵循这一规律的是
A.在 溶液中滴加澄清石灰水 溶液中滴加澄清石灰水 |
| B.催化剂作用下苯乙炔与氢气反应 |
C.在 溶液中滴加氨水 溶液中滴加氨水 |
D.向苯酚钠溶液中通入 |
您最近一年使用:0次
解题方法
4 . 下列反应的离子方程式书写正确的是
A. 溶液中滴加稀硝酸: 溶液中滴加稀硝酸: |
B. 溶液中加入足量NaOH溶液: 溶液中加入足量NaOH溶液: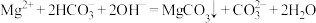 |
C.向 溶液中通入HCl气体,溶液变为黄绿色: 溶液中通入HCl气体,溶液变为黄绿色: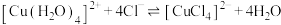 |
D.向 溶液中通入少量 溶液中通入少量 : : |
您最近一年使用:0次
解题方法
5 . X、Y、Z、Q、W是元素周期表前四周期中常见的五种元素,其原子序数依次增大。基态X原子核外3个能级上有电子,且每个能级上的电子数相等;基态Y原子的s电子与P电子数目相同;Z是电负性最大的元素;基态Q原子的未成对电子数是同周期中最多的;W与Q同周期,W的一种核素的质量数为63,中子数为34。
(1)W的元素符号为_______ ,X原子含有_______ 个运动状态不同的电子。
(2) 的空间结构为
的空间结构为_______ ,其中Y原子的杂化轨道类型是_______ 。
(3)Q的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。由Q(III)、 、甲基丙烯酸根形成的配合物的结构为[Q2(CH2=C(CH3)-COO)2Cl4∙6H2O]∙2H2O
、甲基丙烯酸根形成的配合物的结构为[Q2(CH2=C(CH3)-COO)2Cl4∙6H2O]∙2H2O
①甲基丙烯酸中 杂化的碳原子与
杂化的碳原子与 杂化的碳原子的个数之比为
杂化的碳原子的个数之比为_______ ,甲基丙烯酸钠中含有的化学键类型有_______ 。
②过渡元素离子与水形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为 或
或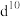 排布时,无颜色;为
排布时,无颜色;为 时,有颜色,如
时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
_______ (填“有”或“无”)颜色。
(1)W的元素符号为
(2)
 的空间结构为
的空间结构为(3)Q的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。由Q(III)、
 、甲基丙烯酸根形成的配合物的结构为[Q2(CH2=C(CH3)-COO)2Cl4∙6H2O]∙2H2O
、甲基丙烯酸根形成的配合物的结构为[Q2(CH2=C(CH3)-COO)2Cl4∙6H2O]∙2H2O①甲基丙烯酸中
 杂化的碳原子与
杂化的碳原子与 杂化的碳原子的个数之比为
杂化的碳原子的个数之比为②过渡元素离子与水形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为
 或
或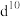 排布时,无颜色;为
排布时,无颜色;为 时,有颜色,如
时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
您最近一年使用:0次
6 . ①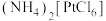 、②
、② 、③
、③ 是铂的三种配合物,下列说法正确的是
是铂的三种配合物,下列说法正确的是
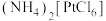 、②
、② 、③
、③ 是铂的三种配合物,下列说法正确的是
是铂的三种配合物,下列说法正确的是A.三种配合物中 的化合价均为 的化合价均为 价 价 |
B.①中 的配位数为6 的配位数为6 |
C.②中 为配体,提供空轨道 为配体,提供空轨道 |
D.向含 ③的溶液中加入足量 ③的溶液中加入足量 溶液,可得到 溶液,可得到 沉淀 沉淀 |
您最近一年使用:0次
解题方法
7 . 辉铜矿[Cu2S,含Fe3O4杂质]合成[Cu(NH3)4]SO4·H2O目标产物的流程如下。下列说法正确的是
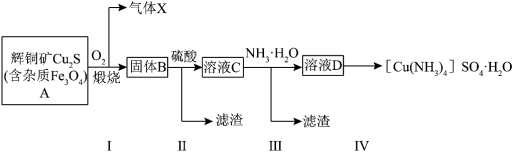

A.步骤I在足量 中煅烧产生气体的主要成分: 中煅烧产生气体的主要成分: |
B.步骤Ⅱ的溶液 中溶质的主要成分:硫酸亚铁和硫酸铜 中溶质的主要成分:硫酸亚铁和硫酸铜 |
| C.步骤Ⅲ可用分液漏斗进行分液 |
| D.实验室模拟步骤Ⅳ的实验操作为:加入95%的乙醇,并用玻璃棒摩擦试管壁 |
您最近一年使用:0次
解题方法
8 . 某化学实验小组设计了铝与相同浓度的不同铜盐溶液反应的实验方案,具体实验操作与现象如下。
下列说法错误的是
| 实验序号 | 实验操作 | 实验现象 |
| ① | 将铝片插入 溶液中 溶液中 | 长时间未观察到红色物质析出 |
| ② | 将铝片插入 溶液中 溶液中 | 15min后,铝片表面析出少量的红色物质,溶液颜色变化不明显 |
| ③ | Ⅰ.将铝片插入 溶液中 溶液中 | 反应迅速、剧烈,溶液呈酱油色样(含CuCl ) ) |
| Ⅱ.将酱油色样溶液倒入大量水中 | 产生白色沉淀(主要成分为CuCl) | |
| Ⅲ.取步骤Ⅱ反应后的上层清液,再插入铝 | 片产生大量无色气体,反应结束后生成大量红色海绵绒状物质,溶液变成无色 |
| A.可在实验①中加入NaCl固体,使铝片溶解 |
B.实验③的步骤Ⅰ中,溶液呈酱油色样的原因: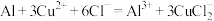 |
| C.实验③的步骤Ⅲ中,无色气体为H2,Cl-在实验Ⅲ中起催化与破坏保护膜的作用 |
D.相同条件下,Cu与等浓度的 溶液、 溶液、 溶液、 溶液、 溶液均不反应 溶液均不反应 |
您最近一年使用:0次
2024-03-15更新
|
176次组卷
|
2卷引用:江西省赣州市2024届高三下学期3月摸底考试化学试题
名校
解题方法
9 . 近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料(Bi-MOF),反应可简单表示为Bi(NO3)3·5H2O+BTC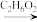 Bi–MOF。回答下列问题:
Bi–MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为___________ 。Bi(NO3)3中阴离子的立体构型为___________ 。基态O原子核外成对电子数与未成对电子数之比为___________ 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为___________ 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
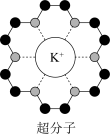
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为___________ 。
②下列叙述正确的是___________ (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。
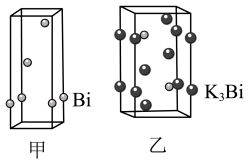
①等晶胞数的甲、乙中含铋原子数之比为___________ 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏加德罗常数的值。该晶体密度___________ g·cm-3(只列计算式)。
 Bi–MOF。回答下列问题:
Bi–MOF。回答下列问题:(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。

已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为
②下列叙述正确的是
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。

①等晶胞数的甲、乙中含铋原子数之比为
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏加德罗常数的值。该晶体密度
您最近一年使用:0次
名校
解题方法
10 . 乙酰丙酮是“一种有酯气味的无色透明液体,常用作溶剂、有机合成中间体、金属络合剂等。它有两种主要互变异构体A、B,与Be2+、Mg2+、Cu2+、Zn2+等形成配合物C.回答下列有关问题:

(1)基态Cu2+的价电子排布式为_______ ,Be和Mg第一电离能较大的是_______ 原子。
(2)A中C原子杂化轨道类型为_______ ;按VSEPR理论预测B中∠HCC约为_______ 、_______ (填角度);B在碱性条件下断裂极性最大的键是_______ ,具有分子内氢键的是_______ (填“A”或“B”)。
(3)C中σ键与π键数目之比为_______ 。
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是_______ 。
(5)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化_______ (填“是”或“否”),理由为_______ 。
(6)金属铜的某些参数如下:
根据上述数据,计算Cu的原子半径为_______ pm(列出计算表达式,设NA是阿伏加德罗常数的值)。

(1)基态Cu2+的价电子排布式为
(2)A中C原子杂化轨道类型为
(3)C中σ键与π键数目之比为
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是
(5)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化
(6)金属铜的某些参数如下:
| 金属 | 堆积类型 | 密度/(g·cm-3) | 相对原子质量 |
| Cu | 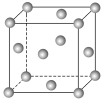 | ρ | 64 |
您最近一年使用:0次



