1 . 实验装置为实验提供必要条件和测量手段。如图装置不能达到实验目的的是
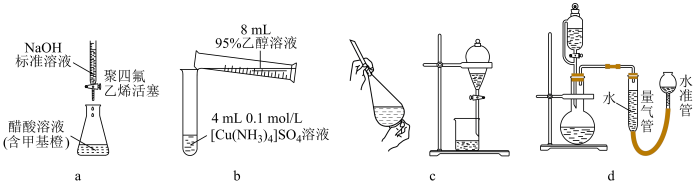
| A.图a测定醋酸溶液的浓度 |
| B.图b制备[Cu(NH3)4]SO4•H2O晶体 |
| C.图c用NaOH溶液除去溴苯中的溴单质 |
| D.图d测定一定质量的Na2O2和Na2O混合物中Na2O2的含量 |
您最近一年使用:0次
7日内更新
|
428次组卷
|
2卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟考卷(二)化学试题
名校
2 . 反应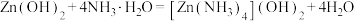 中的有关物质的说法不正确的是
中的有关物质的说法不正确的是
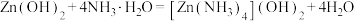 中的有关物质的说法不正确的是
中的有关物质的说法不正确的是A.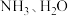 固态时均属于分子晶体 固态时均属于分子晶体 |
B.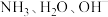 均为 均为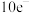 微粒 微粒 |
C. 分子中的键角 分子中的键角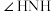 比 比 中的键角 中的键角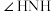 大 大 |
D. 中存在离子键、配位键、极性键 中存在离子键、配位键、极性键 |
您最近一年使用:0次
名校
解题方法
3 . 冠醚是重要的相转移催化剂。18-冠-6是冠醚的一种,其结构如图A,下列说法不正确的是


A.1mol 18-冠-6含 键的数目为 键的数目为 ( ( 为阿伏加德罗常数的值) 为阿伏加德罗常数的值) |
| B.18-冠-6分子间不能形成氢键 |
C.图B中 与18-冠-6的空腔大小相近,且与氧原子之间通过弱相互作用形成超分子结构,体现超分子的分子识别功能 与18-冠-6的空腔大小相近,且与氧原子之间通过弱相互作用形成超分子结构,体现超分子的分子识别功能 |
D.若18-冠-6的部分氢原子被氟原子取代,与 形成的超分子稳定性将增强 形成的超分子稳定性将增强 |
您最近一年使用:0次
4 . 下列有关铁及其化合物的实验方案,对应的现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 将红热的铁与水蒸气在高温条件下反应,反应结束后,将磁铁靠近产物 | 反应结束后有黑色固体生成,且该固体被磁铁吸引 | 铁与水蒸气在高温下反应,生成Fe3O4 |
| B | 取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量。再加入过量稀盐酸和BaCl2溶液 | 加入稀盐酸前,溶液由黄色变为红棕色。加入稀盐酸和BaCl2溶液后产生白色沉淀 | Fe3+和 既发生氧化还原反应,也发生双水解 既发生氧化还原反应,也发生双水解 |
| C | 为了验证Fe2+的还原性,取FeCl2溶液于试管中,加入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫色褪去 | Fe2+具有还原性 |
| D | 向少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后再滴加2滴硫氰化钾溶液 | 溶液变血红色 | CN-与Fe3+的配位能力小于SCN- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . Co3+的八面体配合物为CoClm•nNH3,若1mol此配合物与AgNO3作用生成1molAgCl沉淀,则m、n的值是
| A.m=1,n=5 | B.m=3,n=4 | C.m=4,n=3 | D.m=4,n=5 |
您最近一年使用:0次
名校
6 . 锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。现某科研小组以固体废锌催化剂(主要成分是 ,含少量
,含少量 、
、 、
、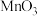 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。
②25℃时,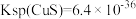 ,
,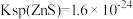
③深度除杂标准:溶液中 ≤2.0×10-6
≤2.0×10-6
(1)“浸取”温度为30℃,锌的浸出率可达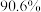 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(2)“滤渣1”的主要成分为 、
、___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ 。
(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。 加入量最优选择
加入量最优选择___________ (填标号)
A.100% B.110% C.120% D.130%
②由图可知,当 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是___________ (用离子方程式解释)。
(5) 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:___________ 。
②键角③___________ 120°(填“<”或“=”)。
 ,含少量
,含少量 、
、 、
、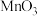 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: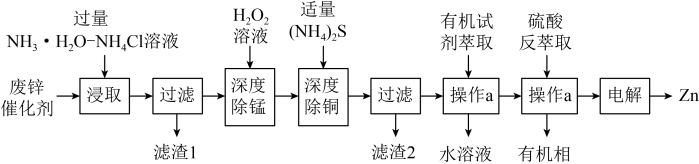
 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。②25℃时,
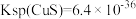 ,
,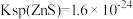
③深度除杂标准:溶液中
 ≤2.0×10-6
≤2.0×10-6(1)“浸取”温度为30℃,锌的浸出率可达
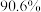 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(2)“滤渣1”的主要成分为
 、
、(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比
 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。
 加入量最优选择
加入量最优选择A.100% B.110% C.120% D.130%
②由图可知,当
 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是(5)
 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图: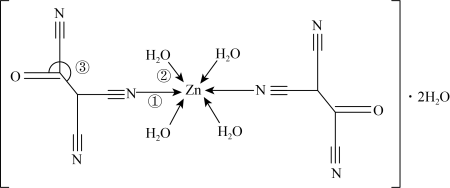
②键角③
您最近一年使用:0次
名校
7 . 某实验小组对 分别与
分别与 、
、 的反应进行实验探究。
的反应进行实验探究。
实验药品:0.1mol/L 溶液(
溶液( );0.1mol/L
);0.1mol/L 溶液(
溶液( );0.05mol/L
);0.05mol/L 溶液(
溶液( );
); 固体;NaCl固体。
固体;NaCl固体。
实验过程
资料:i. 在酸性条件下不稳定,发生自身氧化还原反应;
在酸性条件下不稳定,发生自身氧化还原反应;
ii. (暗紫色),
(暗紫色), 遇
遇 无明显现象。
无明显现象。
(1)配制 溶液时,一般是将固体药品溶于少量浓盐酸,然后再加水稀释,请结合离子方程式解释其可能的原因:
溶液时,一般是将固体药品溶于少量浓盐酸,然后再加水稀释,请结合离子方程式解释其可能的原因:_______ 。
(2)对实验I中现象产生的原因探究如下:
①证明有Fe²⁺生成:取实验I中褪色后的溶液,加入1~2滴 溶液,观察到有蓝色沉淀生成,请写出生成蓝色沉淀的离子方程式:
溶液,观察到有蓝色沉淀生成,请写出生成蓝色沉淀的离子方程式:_______ ; 中的配离子是由
中的配离子是由 和
和 通过配位键形成的,其中提供孤电子对形成配位键的原子是
通过配位键形成的,其中提供孤电子对形成配位键的原子是_______ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是_______ 。
③实验I和Ⅱ对比,I中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是_______ 。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_______ 。
②由实验Ⅳ和实验V得出的结论是_______ 。
 分别与
分别与 、
、 的反应进行实验探究。
的反应进行实验探究。实验药品:0.1mol/L
 溶液(
溶液( );0.1mol/L
);0.1mol/L 溶液(
溶液( );0.05mol/L
);0.05mol/L 溶液(
溶液( );
); 固体;NaCl固体。
固体;NaCl固体。实验过程
| 实验编号 | I | Ⅱ | Ⅲ |
| 实验操作 |
|
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色褪去,久置后不出现淡黄色浑浊 | 溶液呈紫色,静置后紫色缓慢褪去,久置后不出现淡黄色浑浊 |
 在酸性条件下不稳定,发生自身氧化还原反应;
在酸性条件下不稳定,发生自身氧化还原反应;ii.
 (暗紫色),
(暗紫色), 遇
遇 无明显现象。
无明显现象。(1)配制
 溶液时,一般是将固体药品溶于少量浓盐酸,然后再加水稀释,请结合离子方程式解释其可能的原因:
溶液时,一般是将固体药品溶于少量浓盐酸,然后再加水稀释,请结合离子方程式解释其可能的原因:(2)对实验I中现象产生的原因探究如下:
①证明有Fe²⁺生成:取实验I中褪色后的溶液,加入1~2滴
 溶液,观察到有蓝色沉淀生成,请写出生成蓝色沉淀的离子方程式:
溶液,观察到有蓝色沉淀生成,请写出生成蓝色沉淀的离子方程式: 中的配离子是由
中的配离子是由 和
和 通过配位键形成的,其中提供孤电子对形成配位键的原子是
通过配位键形成的,其中提供孤电子对形成配位键的原子是②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和Ⅱ对比,I中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | V |
| 实验操作 |
|
|
| 实验现象 | 紫色褪去时间:a>b | 紫色褪去时间:c<d |
②由实验Ⅳ和实验V得出的结论是
您最近一年使用:0次
8 . 下列离子方程式书写正确的是
A.向硫酸铜溶液中加入过量氨水: |
B.向 溶液中滴入 溶液中滴入 溶液至恰好显中性: 溶液至恰好显中性: |
C.向 溶液中通入过量 溶液中通入过量 : : |
D.向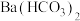 溶液中加入足量氨水: 溶液中加入足量氨水: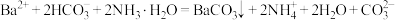 |
您最近一年使用:0次
解题方法
9 . 硫代硫酸钠的制备和应用相关流程如图所示,下列有关离子方程式书写正确的是 。
。
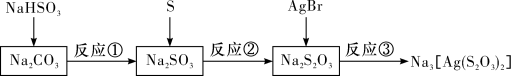
 。
。A.反应③: |
B.向 溶液中加入稀硫酸: 溶液中加入稀硫酸: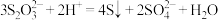 |
C.用 溶液测定碘单质的含量时生成 溶液测定碘单质的含量时生成 ,其离子反应方程式为 ,其离子反应方程式为 |
D.反应①: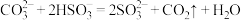 |
您最近一年使用:0次
名校
10 . 氨能与 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。
(1)基态 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为_______ , 中
中 与
与 间形成的化学键为
间形成的化学键为_______ 。
(2)将 置于
置于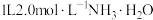 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:
_______ 
_______ 。反应1小时测得溶液中银的总浓度为 ,
, 的溶解速率为
的溶解速率为_______ 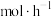 。
。
(3)氨与 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:
(i)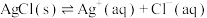
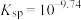
(ii)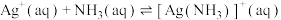
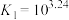
(iii)
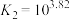
①下列有关说法中,正确的有_______ (填编号)。
A.加少量水稀释,平衡后溶液中 、
、 均减小
均减小
B.随 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大
C.随 增大,
增大, 不变
不变
D.溶液中存在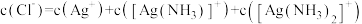
②反应

_______ (用 、
、 、
、 表示)。
表示)。
(4)向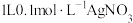 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
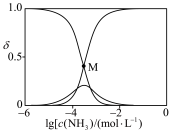
的物质的量分数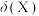 随
随 的变化如图所示。
的变化如图所示。
已知溶液中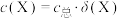 ,
, 。
。
① 点溶液中
点溶液中
_______  。
。
②计算 点溶液中
点溶液中 的转化率
的转化率________ (写出计算过程,已知 )。
)。
 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。(1)基态
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为 中
中 与
与 间形成的化学键为
间形成的化学键为(2)将
 置于
置于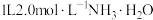 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:

 ,
, 的溶解速率为
的溶解速率为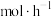 。
。(3)氨与
 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:(i)
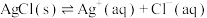
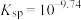
(ii)
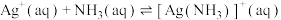
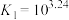
(iii)

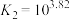
①下列有关说法中,正确的有
A.加少量水稀释,平衡后溶液中
 、
、 均减小
均减小B.随
 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大C.随
 增大,
增大, 不变
不变D.溶液中存在
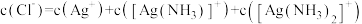
②反应


 、
、 、
、 表示)。
表示)。(4)向
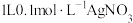 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数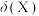 随
随 的变化如图所示。
的变化如图所示。
已知溶液中
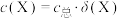 ,
, 。
。①
 点溶液中
点溶液中
 。
。②计算
 点溶液中
点溶液中 的转化率
的转化率 )。
)。
您最近一年使用:0次
2024-04-03更新
|
812次组卷
|
2卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题








