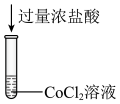
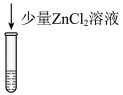
解题方法
1 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①饱和氨水的浓度约为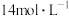
② 为浅青色沉淀
为浅青色沉淀
③ 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)有研究认为蓝色沉淀中还有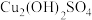 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。___________ ,c=___________ 。
②实验现象是___________ 。
(5)从平衡移动角度,结合化学用语,解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(6)针对实验ii未能成功配制 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:___________ 。
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、___________ 。
| 实验序号 | 操作 | 现象 | |
实验i: 的配制 的配制 | 实验i-a | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的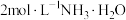 | 产生蓝色沉淀,加入 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的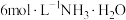 | 产生蓝色沉淀,加入 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的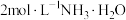 | 产生蓝色沉淀,加入 后沉淀完全溶解,得到澄清的深蓝色溶液。 后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii: 的配制 的配制 | 实验ii-a | 在试管内混合 溶液和过量 溶液和过量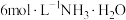 | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合 溶液和过量 溶液和过量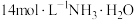 | 得到浅青色沉淀,沉淀未见明显溶解。 | |
实验iii: 的配制 的配制 | 实验iii | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的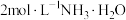 | 产生白色沉淀,加入 后沉淀完全溶解,得到无色溶液。 后沉淀完全溶解,得到无色溶液。 |
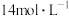
②
 为浅青色沉淀
为浅青色沉淀③
 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)有研究认为蓝色沉淀中还有
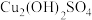 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测
 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。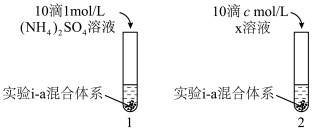
②实验现象是
(5)从平衡移动角度,结合化学用语,解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(6)针对实验ii未能成功配制
 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、
您最近一年使用:0次
2 . 某含氰废水中氰主要以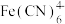 和少量
和少量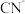 形式存在,对该废水进行除氰处理的步骤如下。
形式存在,对该废水进行除氰处理的步骤如下。
Ⅰ.取一定量处理好的铁屑和活性炭混合物(按照一定的体积比混合);
Ⅱ.加入一定体积的含氰废水,调节 值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液
值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液 ,总氰去除率接近
,总氰去除率接近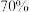 ;
;
Ⅲ.调节滤液 的
的 ,加入一定量的
,加入一定量的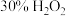 溶液,反应一段时间后过滤,得滤液
溶液,反应一段时间后过滤,得滤液 ,总氰去除率可达
,总氰去除率可达 以上;
以上;
Ⅳ.向滤液 中加入
中加入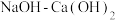 调节
调节 至
至 ,混凝沉淀,经过滤,总氰去除率接近
,混凝沉淀,经过滤,总氰去除率接近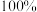 ,得到符合排放标准的废水。
,得到符合排放标准的废水。
(1)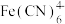 的中心离子是
的中心离子是_______ 。
(2)Ⅰ中,处理过程需用稀硫酸除去铁屑表面的氧化铁,反应的离子方程式是_______ 。
(3)步骤Ⅱ中,生成沉淀的主要成分是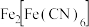 。
。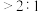 时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是:
时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是: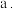 活性炭的吸附性减弱;
活性炭的吸附性减弱;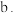
_______ 。
②反应过程中,会有部分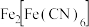 转化为
转化为 ,补全反应的离子方程式
,补全反应的离子方程式_______ 。
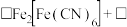 _______
_______ _______
_______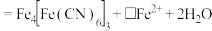
(4)步骤Ⅲ中,其他条件不变,研究 不同对滤液
不同对滤液 中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液
中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液 的
的 为4左右。
为4左右。 可将
可将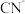 氧化为
氧化为 和
和 ,反应的离子方程式是
,反应的离子方程式是_______ 。
②当 时,随
时,随 增大,总氰去除率下降,可能的原因是
增大,总氰去除率下降,可能的原因是_______ 。
(5)在步骤Ⅳ中产生了胶体,使水中的氰经聚沉而除去。证明有胶体产生的方法是_______ 。
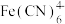 和少量
和少量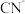 形式存在,对该废水进行除氰处理的步骤如下。
形式存在,对该废水进行除氰处理的步骤如下。Ⅰ.取一定量处理好的铁屑和活性炭混合物(按照一定的体积比混合);
Ⅱ.加入一定体积的含氰废水,调节
 值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液
值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液 ,总氰去除率接近
,总氰去除率接近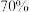 ;
;Ⅲ.调节滤液
 的
的 ,加入一定量的
,加入一定量的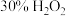 溶液,反应一段时间后过滤,得滤液
溶液,反应一段时间后过滤,得滤液 ,总氰去除率可达
,总氰去除率可达 以上;
以上;Ⅳ.向滤液
 中加入
中加入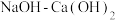 调节
调节 至
至 ,混凝沉淀,经过滤,总氰去除率接近
,混凝沉淀,经过滤,总氰去除率接近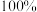 ,得到符合排放标准的废水。
,得到符合排放标准的废水。(1)
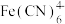 的中心离子是
的中心离子是(2)Ⅰ中,处理过程需用稀硫酸除去铁屑表面的氧化铁,反应的离子方程式是
(3)步骤Ⅱ中,生成沉淀的主要成分是
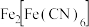 。
。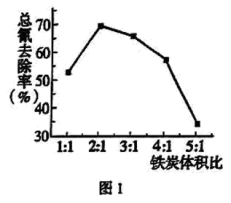
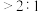 时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是:
时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是: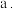 活性炭的吸附性减弱;
活性炭的吸附性减弱;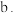
②反应过程中,会有部分
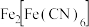 转化为
转化为 ,补全反应的离子方程式
,补全反应的离子方程式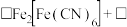 _______
_______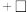 _______
_______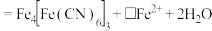
(4)步骤Ⅲ中,其他条件不变,研究
 不同对滤液
不同对滤液 中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液
中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液 的
的 为4左右。
为4左右。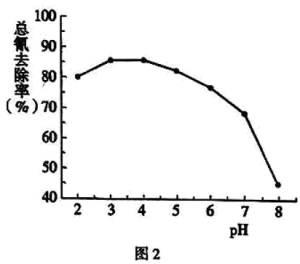
 可将
可将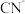 氧化为
氧化为 和
和 ,反应的离子方程式是
,反应的离子方程式是②当
 时,随
时,随 增大,总氰去除率下降,可能的原因是
增大,总氰去除率下降,可能的原因是(5)在步骤Ⅳ中产生了胶体,使水中的氰经聚沉而除去。证明有胶体产生的方法是
您最近一年使用:0次
名校
解题方法
3 . 某小组同学向 溶液中匀速滴加氨水,实验数据及现象记录如下:
溶液中匀速滴加氨水,实验数据及现象记录如下:
经检测,蓝绿色沉淀为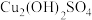 。下列说法正确的是
。下列说法正确的是
 溶液中匀速滴加氨水,实验数据及现象记录如下:
溶液中匀速滴加氨水,实验数据及现象记录如下:时间/s | 0~20 | 20~94 | 94~144 | 144~430 |
pH | 从5.2升高至5.9 | 从5.9升高至6.8 | 从6.8升高至9.5 | 从9.5升高至11.2 |
现象 | 无明显现象 | 产生蓝绿色沉淀,并逐渐增多 | 无明显变化 | 蓝绿色沉淀溶解,溶液变为深蓝色 |
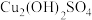 。下列说法正确的是
。下列说法正确的是A.0s时, 是因为 是因为 |
B.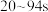 ,主要反应的离子方程式为 ,主要反应的离子方程式为 |
| C.从94s到144s,混合液中水的电离程度增大 |
D.从144s到430s,pH升高与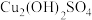 转化为 转化为 的反应有关 的反应有关 |
您最近一年使用:0次
7日内更新
|
145次组卷
|
2卷引用:北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题
4 . 硼氮氢化合物在有机合成、储氢材料等方面备受关注。
氨硼烷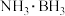 的球棍模型如图所示。
的球棍模型如图所示。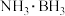 的一种制备方法如下:
的一种制备方法如下:
ⅰ.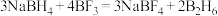 (乙硼烷)
(乙硼烷)
②任何卤化物水解,必先同水分子配位
(1) 中硼元素的化合价为
中硼元素的化合价为___________ 。
(2) 不能水解,但
不能水解,但 能水解。原因是
能水解。原因是___________ 。
(3)在水中的溶解性:THF>环戊烷,原因是___________ 。
(4)此法生成的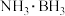 会继续与
会继续与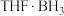 反应生成副产物
反应生成副产物 。过程如下:
。过程如下:___________ 能量(填“吸收”或“放出”)。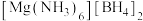 的晶胞形状为立方体,边长为
的晶胞形状为立方体,边长为 ,如下图所示。
,如下图所示。 距离最近且等距的
距离最近且等距的 有
有___________ 个。
②已知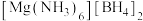 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,此晶体的密度为
,此晶体的密度为___________  。(
。( )
)
氨硼烷
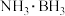 的球棍模型如图所示。
的球棍模型如图所示。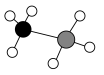
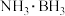 的一种制备方法如下:
的一种制备方法如下:ⅰ.
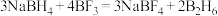 (乙硼烷)
(乙硼烷)ⅱ.
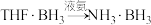
②任何卤化物水解,必先同水分子配位
(1)
 中硼元素的化合价为
中硼元素的化合价为(2)
 不能水解,但
不能水解,但 能水解。原因是
能水解。原因是(3)在水中的溶解性:THF>环戊烷,原因是
(4)此法生成的
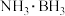 会继续与
会继续与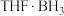 反应生成副产物
反应生成副产物 。过程如下:
。过程如下: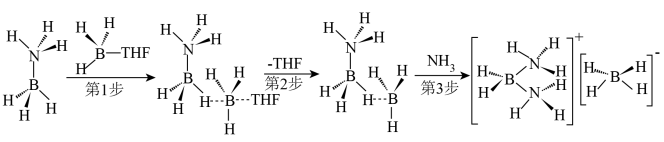
②用DMA(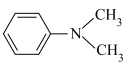 )代替THF可以得到纯净的氨硼烷。由此推测
)代替THF可以得到纯净的氨硼烷。由此推测 、THF和DMA分别与B原子的结合能力由大到小的顺序为
、THF和DMA分别与B原子的结合能力由大到小的顺序为
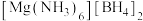 的晶胞形状为立方体,边长为
的晶胞形状为立方体,边长为 ,如下图所示。
,如下图所示。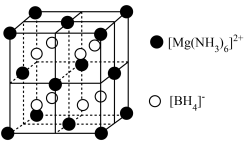
 距离最近且等距的
距离最近且等距的 有
有②已知
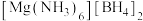 的摩尔质量为
的摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,此晶体的密度为
,此晶体的密度为 。(
。( )
)
您最近一年使用:0次
5 . Ⅰ.经研究表明,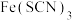 是配合物,
是配合物, 与
与 不仅能以1:3的个数比配合,还可以其他个数比配合。
不仅能以1:3的个数比配合,还可以其他个数比配合。
(1) 中所有原子都达到
中所有原子都达到 稳定结构,请画出
稳定结构,请画出 的结构式
的结构式______ ,若其中主要是 与
与 以个数比1:1配合所得离子,显血红色,该离子的离子符号是
以个数比1:1配合所得离子,显血红色,该离子的离子符号是______ 。
(2)若 与
与 以个数比1:5配合,则
以个数比1:5配合,则 与KSCN在水溶液中发生反应的化学方程式可以表示为
与KSCN在水溶液中发生反应的化学方程式可以表示为______ 。
(3)Fe还能与CO形成配合物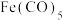 ,该配合物中的配位原子是
,该配合物中的配位原子是______ (写元素符号)。
(4) 溶液可吸收NO生成配合物
溶液可吸收NO生成配合物 ,减少环境污染。下列说法正确的是 。
,减少环境污染。下列说法正确的是 。
Ⅱ.铜的单质及其化合物应用广泛:研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;硫酸铜可用于制农药波尔多液。
(5)向硫酸铜溶液中逐滴加入氨水,形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请画出深蓝色离子的结构。______ ;再加入乙醇后,析出深蓝色的晶体,请写出深蓝色晶体的化学式:______ 。
(6)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色溶液,写出离子方程式:______ 。
(7) 结构示意图如下,
结构示意图如下, 中存在的相互作用有
中存在的相互作用有______ (填序号)。
(8)青霉胺可用于医学上误食铜盐的解毒,解毒原理: 形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
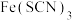 是配合物,
是配合物, 与
与 不仅能以1:3的个数比配合,还可以其他个数比配合。
不仅能以1:3的个数比配合,还可以其他个数比配合。(1)
 中所有原子都达到
中所有原子都达到 稳定结构,请画出
稳定结构,请画出 的结构式
的结构式 与
与 以个数比1:1配合所得离子,显血红色,该离子的离子符号是
以个数比1:1配合所得离子,显血红色,该离子的离子符号是(2)若
 与
与 以个数比1:5配合,则
以个数比1:5配合,则 与KSCN在水溶液中发生反应的化学方程式可以表示为
与KSCN在水溶液中发生反应的化学方程式可以表示为(3)Fe还能与CO形成配合物
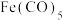 ,该配合物中的配位原子是
,该配合物中的配位原子是(4)
 溶液可吸收NO生成配合物
溶液可吸收NO生成配合物 ,减少环境污染。下列说法正确的是 。
,减少环境污染。下列说法正确的是 。| A.该配合物中所含非金属元素均位于元素周期表的p区 |
B. 提供孤电子对用于形成配位键 提供孤电子对用于形成配位键 |
| C.该配合物中阴离子空间结构为正四面体形 |
D.配离子为 ,中心离子的配位数为5 ,中心离子的配位数为5 |
Ⅱ.铜的单质及其化合物应用广泛:研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;硫酸铜可用于制农药波尔多液。
(5)向硫酸铜溶液中逐滴加入氨水,形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请画出深蓝色离子的结构。
(6)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色溶液,写出离子方程式:
(7)
 结构示意图如下,
结构示意图如下, 中存在的相互作用有
中存在的相互作用有
(8)青霉胺可用于医学上误食铜盐的解毒,解毒原理:
 形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
A.共价键键角的大小关系为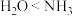 |
B.电负性大小关系为 |
| C.该配合物易溶于水的主要原因是其与水可形成分子间氢键 |
D.与铜离子形成配位键强弱的大小关系为 |
您最近一年使用:0次
6 . 工业锌粉常用于制造防锈漆等,其主要成分为金属锌,还有少量含锌化合物及其他杂质,锌单质的含量及锌元素的总量影响着工业锌粉的等级。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:_________ 。
(2)酸性介质中电沉积制锌粉:以 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
①阴极的电极反应有_________ 。
②制得65g锌粉时,电解质溶液中 的物质的量至少增加
的物质的量至少增加_________ mol。
(3)离子液体电沉积制锌:80℃时,将 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:_________ 。
i.二甲酚橙(In)与 反应:
反应:
EDTA与 反应:
反应: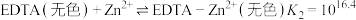
ii. 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
(4)滴定终点时的现象是_________ 。
(5)计算样品中锌元素的质量分数还需要的实验数据有_________ 。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入
 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:(2)酸性介质中电沉积制锌粉:以
 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。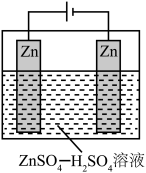

①阴极的电极反应有
②制得65g锌粉时,电解质溶液中
 的物质的量至少增加
的物质的量至少增加(3)离子液体电沉积制锌:80℃时,将
 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因: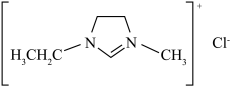

i.二甲酚橙(In)与
 反应:
反应:
EDTA与
 反应:
反应: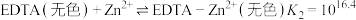
ii.
 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。(4)滴定终点时的现象是
(5)计算样品中锌元素的质量分数还需要的实验数据有
您最近一年使用:0次
7 . 某小组对 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是
资料:
 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是资料:
| 物质 |  |  |  | ||||
| 溶液中的颜色 | 粉红色 | 蓝色 | 无色 | ||||
| 操作 |
| 将a中得到的蓝色溶液均分为3份,分别倒入试管 、 、 、 、 中 中 | |||||
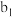 |
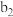 |
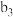 | |||||
| 现象 | a中现象:加入浓盐酸后,溶液由粉红色变为蓝色 | 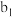 中现象:溶液变为粉红色 中现象:溶液变为粉红色 | 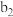 中现象 中现象 | 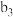 中现象 中现象 | |||
A.试管a中存在平衡: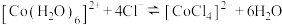 |
B.由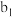 中现象可推测稳定性: 中现象可推测稳定性: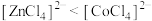 |
C.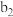 中现象可能为产生白色沉淀 中现象可能为产生白色沉淀 |
D.推测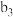 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 |
您最近一年使用:0次
名校
8 . 下列方程式书写正确的是
A.向氢氧化钡溶液中逐滴加入稀硫酸: |
B.实验室制备乙炔: |
C.铜片与稀硝酸反应产生无色气泡: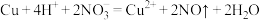 |
D.向氢氧化铜浊液中加入足量氨水得深蓝色溶液: |
您最近一年使用:0次
2024-05-06更新
|
120次组卷
|
2卷引用:北京市顺义牛栏山第一中学2023-2024学年高二下学期4月月考化学试题
9 . 过渡元素铂(Pt)的单质是一种重要的催化剂,其化合物可用于医药领域。
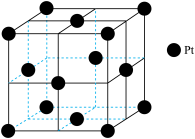
(1)基态Pt的价层电子排布式是5d96s1,该元素在元素周期表中位于第___________ 周期。
(2)Pt的晶胞示意图如下。___________ 个。
(3)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2,但只有甲的水解产物能与草酸(HOOC-COOH)反应生成Pt(C2O4)(NH3)2。
①推断___________ (填“甲”或“乙”)在水中的溶解度较大,依据是___________ 。
②依据文中信息:___________ ,可推断PtCl2(NH3)2的分子不是四面体结构。
③PtCl2(NH3)2发生水解反应的化学方程式是___________ 。
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中铂的配体数不同,但配位数均为4,原因是___________ 。
⑤画出乙的水解产物的空间结构并推测其不能与草酸反应生成Pt(C2O4)(NH3)2的原因___________ 。
(1)基态Pt的价层电子排布式是5d96s1,该元素在元素周期表中位于第
(2)Pt的晶胞示意图如下。
(3)PtCl2(NH3)2是铂的重要配位化合物,它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙水解产物的化学式均为Pt(OH)2(NH3)2,但只有甲的水解产物能与草酸(HOOC-COOH)反应生成Pt(C2O4)(NH3)2。
①推断
②依据文中信息:
③PtCl2(NH3)2发生水解反应的化学方程式是
④PtCl2(NH3)2和Pt(C2O4)(NH3)2中铂的配体数不同,但配位数均为4,原因是
⑤画出乙的水解产物的空间结构并推测其不能与草酸反应生成Pt(C2O4)(NH3)2的原因
您最近一年使用:0次
名校
解题方法
10 . 某课外小组探究Cu(Ⅱ)盐与Na2S2O3溶液的反应。
【查阅资料】
ⅰ. 2 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):
ⅱ. 2NH3+Cu+ [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;
假设2:Cu(Ⅱ)有氧化性,Cu2+与 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是___________ (填化学式)。
(2)甲同学认为实验一可证明假设2成立,他的理由是___________ 。
实验二:探究CuCl2与Na2S2O3的反应。___________ (补全实验方案),则说明含Cu(Ⅰ)。
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:___________ 。
(5)经检验氧化产物以 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n( ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生___________ 的趋势减弱;
②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和 发生
发生___________ 的趋势。
【查阅资料】
ⅰ. 2
 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):ⅱ. 2NH3+Cu+
 [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与
 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;假设2:Cu(Ⅱ)有氧化性,Cu2+与
 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
| 实验操作 | 实验序号 | V1(mL) | V2(mL) | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是
(2)甲同学认为实验一可证明假设2成立,他的理由是
实验二:探究CuCl2与Na2S2O3的反应。
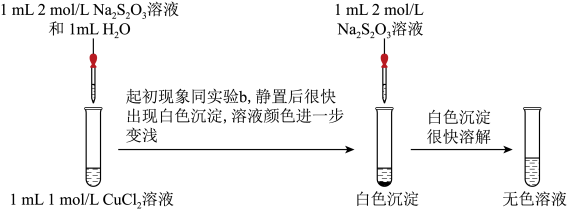
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:
(5)经检验氧化产物以
 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n(
 ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和
 发生
发生
您最近一年使用:0次