1 . 下列离子方程式书写正确的是
A.向硫酸铜溶液中加入过量氨水: |
B.向 溶液中滴入 溶液中滴入 溶液至恰好显中性: 溶液至恰好显中性: |
C.向 溶液中通入过量 溶液中通入过量 : : |
D.向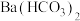 溶液中加入足量氨水: 溶液中加入足量氨水: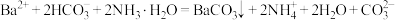 |
您最近一年使用:0次
解题方法
2 . 硫在古代被列为重要的药材,目前含硫化合物广泛用于医药、农药等。回答下列问题:
(1)硫离子的价电子排布图为___________ 。
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一、一种铁硫原子簇的结构如图所示:

该化合物的化学式为___________ ,中心原子Fe的配位数为___________ 。
(3)解砷灵的结构简式为 。―SH和
。―SH和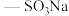 中硫原子的杂化轨道类型分别是
中硫原子的杂化轨道类型分别是___________ 、___________ ;1mol 中含
中含___________ mol 键。
键。
(4) 及
及 的分子结构及相应的键角如图所示。
的分子结构及相应的键角如图所示。

 的键角小于
的键角小于 的原因是
的原因是___________ 。
(5) 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为___________ 。
(6)已知硫化锰(MnS)晶胞如图所示,该晶胞参数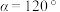 ,
, 。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别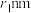 和
和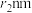 ,该晶体中原子的空间利用率为
,该晶体中原子的空间利用率为___________ (列出计算式即可)。

(1)硫离子的价电子排布图为
(2)铁硫簇是普遍存在于生物体内的最古老的生命物质之一、一种铁硫原子簇的结构如图所示:

该化合物的化学式为
(3)解砷灵的结构简式为
 。―SH和
。―SH和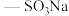 中硫原子的杂化轨道类型分别是
中硫原子的杂化轨道类型分别是 中含
中含 键。
键。(4)
 及
及 的分子结构及相应的键角如图所示。
的分子结构及相应的键角如图所示。
 的键角小于
的键角小于 的原因是
的原因是(5)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为(6)已知硫化锰(MnS)晶胞如图所示,该晶胞参数
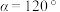 ,
, 。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
。已知空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别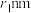 和
和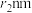 ,该晶体中原子的空间利用率为
,该晶体中原子的空间利用率为
您最近一年使用:0次
名校
3 . 氨能与 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。
(1)基态 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为_______ , 中
中 与
与 间形成的化学键为
间形成的化学键为_______ 。
(2)将 置于
置于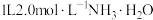 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:
_______ 
_______ 。反应1小时测得溶液中银的总浓度为 ,
, 的溶解速率为
的溶解速率为_______ 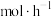 。
。
(3)氨与 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:
(i)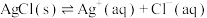
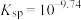
(ii)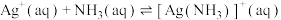
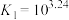
(iii)
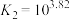
①下列有关说法中,正确的有_______ (填编号)。
A.加少量水稀释,平衡后溶液中 、
、 均减小
均减小
B.随 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大
C.随 增大,
增大, 不变
不变
D.溶液中存在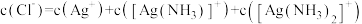
②反应

_______ (用 、
、 、
、 表示)。
表示)。
(4)向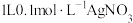 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数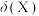 随
随 的变化如图所示。
的变化如图所示。
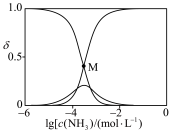
已知溶液中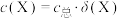 ,
, 。
。
① 点溶液中
点溶液中
_______  。
。
②计算 点溶液中
点溶液中 的转化率
的转化率________ (写出计算过程,已知 )。
)。
 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。(1)基态
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为 中
中 与
与 间形成的化学键为
间形成的化学键为(2)将
 置于
置于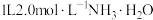 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:

 ,
, 的溶解速率为
的溶解速率为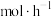 。
。(3)氨与
 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:(i)
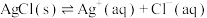
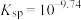
(ii)
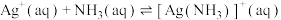
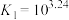
(iii)

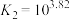
①下列有关说法中,正确的有
A.加少量水稀释,平衡后溶液中
 、
、 均减小
均减小B.随
 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大C.随
 增大,
增大, 不变
不变D.溶液中存在
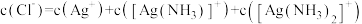
②反应


 、
、 、
、 表示)。
表示)。(4)向
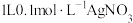 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数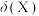 随
随 的变化如图所示。
的变化如图所示。
已知溶液中
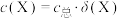 ,
, 。
。①
 点溶液中
点溶液中
 。
。②计算
 点溶液中
点溶液中 的转化率
的转化率 )。
)。
您最近一年使用:0次
2024-04-03更新
|
812次组卷
|
2卷引用:广东省广州市2024届高三下学期一模考试化学试题
解题方法
4 . 辉铜矿[Cu2S,含Fe3O4杂质]合成[Cu(NH3)4]SO4·H2O目标产物的流程如下。下列说法正确的是
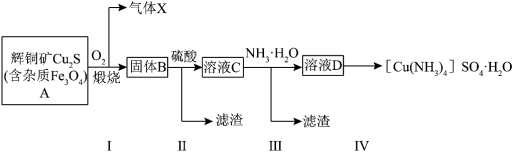

A.步骤I在足量 中煅烧产生气体的主要成分: 中煅烧产生气体的主要成分: |
B.步骤Ⅱ的溶液 中溶质的主要成分:硫酸亚铁和硫酸铜 中溶质的主要成分:硫酸亚铁和硫酸铜 |
| C.步骤Ⅲ可用分液漏斗进行分液 |
| D.实验室模拟步骤Ⅳ的实验操作为:加入95%的乙醇,并用玻璃棒摩擦试管壁 |
您最近一年使用:0次
解题方法
5 . 部分含Fe或含Cu物质的分类与相应化合价关系如下图所示,下列推断不合理的是
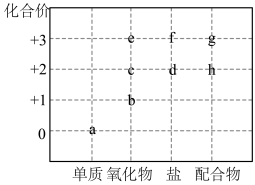

| A.c为黑色固体 | B.a与 反应只生成d 反应只生成d |
| C.g与h均含有σ键 | D.可存在a→c→d→h的转化 |
您最近一年使用:0次
6 . 氯化钯是一种重要的无机化合物,广泛应用于催化剂、电镀材料、金属颜料、钯合金制备等领域。以[Pd(NH3)2]Cl2固体为原料制备纯PdCl2,其部分流程如图所示:
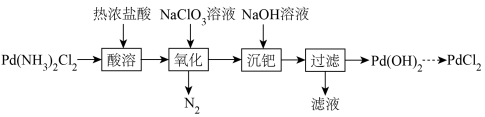
已知:① ;
;
②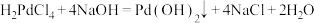 ,Pd(OH)2有两性,
,Pd(OH)2有两性, ;
;
③ 。
。
下列说法正确的是

已知:①
 ;
;②
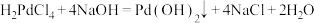 ,Pd(OH)2有两性,
,Pd(OH)2有两性, ;
;③
 。
。下列说法正确的是
| A.“酸溶”时,温度越高,反应效果越好 |
B.NH3、NH 都可以被NaClO3“氧化”,流程图中“氧化”和“酸溶”的顺序可以顺倒 都可以被NaClO3“氧化”,流程图中“氧化”和“酸溶”的顺序可以顺倒 |
| C.Pd(OH)2只能溶于NaOH溶液不能溶于氨水 |
| D.“氧化”不充分,“沉钯”时所得Pd(OH)2的产率会降低 |
您最近一年使用:0次
2024-03-18更新
|
194次组卷
|
2卷引用:河北省石家庄市辛集中学、衡水中学2023-2024高三上学期期末联考化学试题
名校
解题方法
7 . 2020年,比亚迪宣布推出基于磷酸铁锂技术的“刀片电池”,刀片电池能量密度大,安全性高。电池的正极活性材料是 。请回答下列问题
。请回答下列问题
(1)铁元素位于周期表第四周期第___________ 族;基态 的最外层电子排布式为
的最外层电子排布式为___________ 。
(2)正极材料 的阴离子
的阴离子 的空间结构为
的空间结构为___________ ,请写出一个与 为等电子体的分子
为等电子体的分子___________ 。
(3) 原子或离子外围有较多能量相近的空轨道,能与
原子或离子外围有较多能量相近的空轨道,能与 等形成配合物。
等形成配合物。
① 与
与 形成配位键时,提供孤电子对的原子是
形成配位键时,提供孤电子对的原子是___________ ,1mol[Fe(SCN)6]3-的 键数目为
键数目为___________ 。
②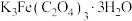 为可溶于水的晶体,某同学欲检验该晶体中
为可溶于水的晶体,某同学欲检验该晶体中 元素的价态,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴
元素的价态,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴 溶液。
溶液。
已知:i.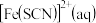 为血红色:
为血红色:
ii. 时,
时,
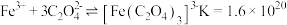
上述实验方案___________ (填“可行”或“不可行”),并解释其原因___________ 。
 。请回答下列问题
。请回答下列问题(1)铁元素位于周期表第四周期第
 的最外层电子排布式为
的最外层电子排布式为(2)正极材料
 的阴离子
的阴离子 的空间结构为
的空间结构为 为等电子体的分子
为等电子体的分子(3)
 原子或离子外围有较多能量相近的空轨道,能与
原子或离子外围有较多能量相近的空轨道,能与 等形成配合物。
等形成配合物。①
 与
与 形成配位键时,提供孤电子对的原子是
形成配位键时,提供孤电子对的原子是 键数目为
键数目为②
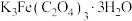 为可溶于水的晶体,某同学欲检验该晶体中
为可溶于水的晶体,某同学欲检验该晶体中 元素的价态,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴
元素的价态,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴 溶液。
溶液。已知:i.
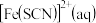 为血红色:
为血红色:ii.
 时,
时,
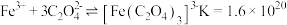
上述实验方案
您最近一年使用:0次
2024-03-13更新
|
365次组卷
|
2卷引用:山东省青岛第五十八中学2023-2024学年高二上学期期末化学试卷
名校
解题方法
8 . 近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料(Bi-MOF),反应可简单表示为Bi(NO3)3·5H2O+BTC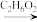 Bi–MOF。回答下列问题:
Bi–MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为___________ 。Bi(NO3)3中阴离子的立体构型为___________ 。基态O原子核外成对电子数与未成对电子数之比为___________ 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为___________ 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
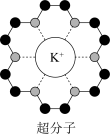
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为___________ 。
②下列叙述正确的是___________ (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。
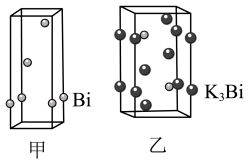
①等晶胞数的甲、乙中含铋原子数之比为___________ 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏加德罗常数的值。该晶体密度___________ g·cm-3(只列计算式)。
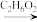 Bi–MOF。回答下列问题:
Bi–MOF。回答下列问题:(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。

已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为
②下列叙述正确的是
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。

①等晶胞数的甲、乙中含铋原子数之比为
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏加德罗常数的值。该晶体密度
您最近一年使用:0次
名校
解题方法
9 . 三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,下列说法正确的是
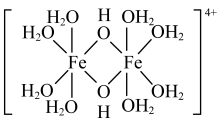

| A.该二聚体中Fe3+的配位数为4 |
| B.该二聚体中H2O作配体,其中氢原子是配位原子 |
| C.该二聚体中存在非极性共价键、配位键、离子键 |
| D.该二聚体中Fe3+的杂化轨道中轨道数为6 |
您最近一年使用:0次
名校
10 . 电极活性物质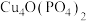 的制备,可通过下列反应制备:
的制备,可通过下列反应制备: 。
。
(1)上述反应涉及的元素中不属于元素周期表p区元素的是___________ ,写出基态 的电子排布式
的电子排布式___________ 。
(2)P、S元素第一电离能大小关系为P___________ S(填“>”、“<”或“=”),原因是___________ 。
(3)O的原子核外有___________ 种不同能量的电子,其氢化物沸点高于同族元素H2S的原因是___________ 。
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液 ,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是
,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是___________ 。
A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为
写出沉淀溶解生成深蓝色溶液的离子方程式___________ 。
(5)①在硫酸铜溶液中加入过量KCN,生成配合物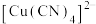 ,则1 mol该配合物含π键的数目为
,则1 mol该配合物含π键的数目为___________ 。
②画出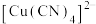 的结构:
的结构:___________ (用“→”或“—”将配位键表示出来)。
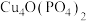 的制备,可通过下列反应制备:
的制备,可通过下列反应制备: 。
。(1)上述反应涉及的元素中不属于元素周期表p区元素的是
 的电子排布式
的电子排布式(2)P、S元素第一电离能大小关系为P
(3)O的原子核外有
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液
 ,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是
,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为

写出沉淀溶解生成深蓝色溶液的离子方程式
(5)①在硫酸铜溶液中加入过量KCN,生成配合物
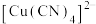 ,则1 mol该配合物含π键的数目为
,则1 mol该配合物含π键的数目为②画出
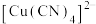 的结构:
的结构:
您最近一年使用:0次



