1 . 乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等形成稳定环状离子,其中Cu2+与乙二胺形成的化合物稳定性更高。下列说法错误的是
| A.铜的第二电离能小于锌的第二电离能 |
| B.乙二胺中2个N原子均可与Cu2+形成配位键 |
| C.Cu2+与乙二胺形成的化合物稳定性更高是因为Cu2+半径大,配体之间的斥力小 |
| D.基态Mg原子中,电子占据的最高能层具有的原子轨道为9 |
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
2 . 配位键
(1)概念:由一个原子单方面提供_____________ ,而另一个原子提供_____________ 而形成的化学键,即“电子对给予—接受”键。
(2)表示方法:配位键常用A—B表示,其中A是_____________ 孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫_____________ 。
如:H3O+的结构式为 ;NH
;NH 的结构式为
的结构式为 。
。
(3)形成条件:形成配位键的一方(如A)是能够提供_____________ 的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。
(1)概念:由一个原子单方面提供
(2)表示方法:配位键常用A—B表示,其中A是
如:H3O+的结构式为
 ;NH
;NH 的结构式为
的结构式为 。
。(3)形成条件:形成配位键的一方(如A)是能够提供
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
3 . 配合物
(1)概念:通常把金属离子或原子(称为_____________ 或原子)与某些分子或离子(称为_____________ )以_____________ 结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。
(2)组成:配合物[Cu(NH3)4]SO4的组成如图所示:

①中心原子:提供_____________ 接受_____________ 的原子。中心原子一般都是带正电荷的阳离子(此时又叫_____________ ),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。
②配体:提供_____________ 的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同_____________ 的原子叫做配位原子。配位原子必须是含有_____________ 的原子,如NH3中的N原子,H2O中的O原子等。
③配位数:直接与中心原子形成的_____________ 的数目。如[Fe(CN)6]4-中Fe2+的配位数为_____________ 。
(3)常见配合物的形成实验
(4)配合物的形成对性质的影响
①对溶解性的影响:一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。
②颜色的改变:当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显_____________ 。
③稳定性增强
配合物具有一定的稳定性,配合物中的配位键越_____________ ,配合物越_____________ 。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
(1)概念:通常把金属离子或原子(称为
(2)组成:配合物[Cu(NH3)4]SO4的组成如图所示:

①中心原子:提供
②配体:提供
③配位数:直接与中心原子形成的
(3)常见配合物的形成实验
| 实验操作 | 实验现象 | 有关离子方程式 |
 | 滴加氨水后,试管中首先出现 | Cu2++2NH3·H2O=Cu(OH)2↓+2NH 、Cu(OH)2+4NH3= [Cu(NH3)4]2++2OH-、[Cu(NH3)4]2++SO 、Cu(OH)2+4NH3= [Cu(NH3)4]2++2OH-、[Cu(NH3)4]2++SO +H2O +H2O [Cu(NH3)4]SO4·H2O↓ [Cu(NH3)4]SO4·H2O↓ |
 | 溶液变为 | Fe3++3SCN-=Fe(SCN)3 |
 | 滴加AgNO3溶液后,试管中出现 | Ag++Cl-=AgCl↓、AgCl+2NH3=[Ag(NH3)2]++Cl- |
①对溶解性的影响:一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。
②颜色的改变:当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显
③稳定性增强
配合物具有一定的稳定性,配合物中的配位键越
您最近一年使用:0次
名校
4 . 铜及其化合物在工农业生产中有广泛的应用。
Ⅰ.金属铜的原子堆积模型如图-1所示,
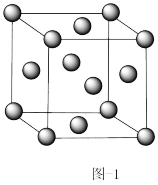
(1)该晶胞中每个Cu原子周围最近距离的Cu原子数目为_______ 。
Ⅱ. 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。
(2)向 溶液中加入过量NaOH溶液可生成
溶液中加入过量NaOH溶液可生成 。
。 中除了配位键外,还存在的化学键类型有_______(填字母)。
中除了配位键外,还存在的化学键类型有_______(填字母)。
(3)将CuO投入 、
、 的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为
的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为 溶液。
溶液。
①CuO被浸取的离子方程式为_______ 。
② 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的化合物,由此推测
分子,可以得到两种不同结构的化合物,由此推测 的空间构型为
的空间构型为_______ 。
(4) 可以与乙二胺(
可以与乙二胺(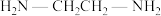 )形成配离子,如题图-2所示:
)形成配离子,如题图-2所示:
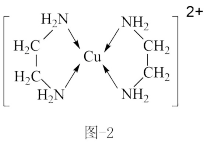
③H、O、N三种元素的电负性从大到小的顺序为_______ 。
④乙二胺分子中N原子成键时采取的杂化类型是_______ 。乙二胺和三甲胺 均属于胺,但乙二胺比三甲胺的沸点高很多,原因是
均属于胺,但乙二胺比三甲胺的沸点高很多,原因是_______ 。
Ⅲ.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,
(5)下列物质中,属于顺磁性物质的是_______ (填标号)。
A. B.
B. C.
C.
Ⅰ.金属铜的原子堆积模型如图-1所示,

(1)该晶胞中每个Cu原子周围最近距离的Cu原子数目为
Ⅱ.
 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。(2)向
 溶液中加入过量NaOH溶液可生成
溶液中加入过量NaOH溶液可生成 。
。 中除了配位键外,还存在的化学键类型有_______(填字母)。
中除了配位键外,还存在的化学键类型有_______(填字母)。| A.离子键 | B.金属键 | C.极性共价键 | D.非极性共价键 |
 、
、 的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为
的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为 溶液。
溶液。①CuO被浸取的离子方程式为
②
 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的化合物,由此推测
分子,可以得到两种不同结构的化合物,由此推测 的空间构型为
的空间构型为(4)
 可以与乙二胺(
可以与乙二胺(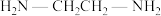 )形成配离子,如题图-2所示:
)形成配离子,如题图-2所示: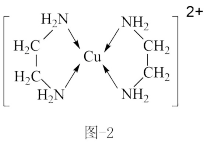
③H、O、N三种元素的电负性从大到小的顺序为
④乙二胺分子中N原子成键时采取的杂化类型是
 均属于胺,但乙二胺比三甲胺的沸点高很多,原因是
均属于胺,但乙二胺比三甲胺的沸点高很多,原因是Ⅲ.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,
(5)下列物质中,属于顺磁性物质的是
A.
 B.
B. C.
C.
您最近一年使用:0次
2022-11-11更新
|
1387次组卷
|
4卷引用:第三章 晶体结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
解题方法
5 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氨、钛、钙等多种化学元素。请回答下列问题:
(1)科学家常利用____ 区分晶体硼和无定形硼,二者的关系是互为____ ;第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第____ 位,其基态原子能量最低的能级电子云轮廓图为____ 。
(2)N元素位于元素周期表____ 区;该元素形成的氢化物的沸点比同族元素磷的氢化物沸点高,其原因为_____ 。
(3)①[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。[Co(NH3)6]3+中,1个Co提供____ 个空轨道,该配离子的作用力为_____ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_____ 种不同的结构。
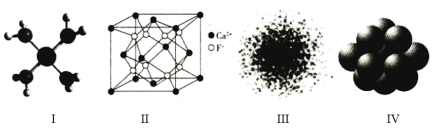
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图所示。与Ti紧邻的Ca有___ 个。

(1)科学家常利用
(2)N元素位于元素周期表
(3)①[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。[Co(NH3)6]3+中,1个Co提供
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成
(4)一种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图所示。与Ti紧邻的Ca有

您最近一年使用:0次
解题方法
6 . 过渡元素铜的配合物在物质制备、尖端技术、医药科学、催化反应、材料化学等领域有着广泛的应用。请回答下列问题:
(1)科学家推测胆矾(CuSO4•5H2O)的结构示意图可简单表示如图:
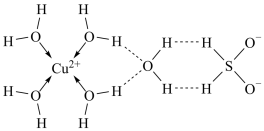
用配合物的形式表示胆矾的化学式为_____ ;SO 的空间结构为
的空间结构为____ ,其中硫原子的杂化轨道类型为____ 。
(2)Cu能与(SCN)2反应生成Cu(SCN)2。1mol(SCN)2中含有的π键数目为____ (设NA为阿伏加德罗常数的值)。
(3)向硫酸铜溶液中加入NaCl固体,溶液由蓝色变为黄绿色,则溶液中铜元素的主要存在形式是_____ (写微粒符号);向上述溶液中滴加浓氨水,先有蓝色沉淀生成,继续滴加浓氨水后,沉淀溶解,溶液变为深蓝色。沉淀溶解的原因是_____ (用离子方程式表示)。
(4)Cu单独与氨水、过氧化氢都不反应,但能与氨水和过氧化氢的混合溶液反应,反应的离子方程式为____ 。
(1)科学家推测胆矾(CuSO4•5H2O)的结构示意图可简单表示如图:

用配合物的形式表示胆矾的化学式为
 的空间结构为
的空间结构为(2)Cu能与(SCN)2反应生成Cu(SCN)2。1mol(SCN)2中含有的π键数目为
(3)向硫酸铜溶液中加入NaCl固体,溶液由蓝色变为黄绿色,则溶液中铜元素的主要存在形式是
(4)Cu单独与氨水、过氧化氢都不反应,但能与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 水合硫酸四氨合铜 在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是
在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是
 在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是
在工业上用途广泛,主要用于印染、纤维、杀虫剂及制备某些含铜的化合物。下列叙述错误的是A. 中 中 的空间结构为平面三角形 的空间结构为平面三角形 |
B. 的配位数是6 的配位数是6 |
C. 分子中 分子中 键的键角大于 键的键角大于 分子中 分子中 键的键角 键的键角 |
D. 和 和 与 与 的配位能力: 的配位能力: |
您最近一年使用:0次
2022-08-22更新
|
148次组卷
|
2卷引用:专题4 分子空间结构与物质性质 第一~二单元综合拔高练
8 . 下列有关说法正确的是

| A.水合铜离子的模型如图I,该微粒中存在极性共价键、配位键、离子键 |
B. 晶体的晶胞如图II,距离 晶体的晶胞如图II,距离 最近的 最近的 组成正四面体 组成正四面体 |
| C.氢原子的电子云图如图III,氢原子核外大多数电子在原子核附近运动 |
| D.金属Cu中Cu原子堆积模型如图IV,为面心立方堆积,Cu原子的配位数为8 |
您最近一年使用:0次
名校
解题方法
9 . 关于[Ti(NH3)5Cl]Cl2]的说法中,错误的是
| A.中心原子的配位数是6 |
| B.Ti的化合价为+3价 |
| C.1mol[Ti(NH3)5Cl]Cl2含有σ键的数目为15NA |
| D.含1mol[Ti(NH3)5Cl]Cl2]的水溶液中加入足量AgNO3溶液,产生2mol白色沉淀 |
您最近一年使用:0次
2022-08-22更新
|
583次组卷
|
7卷引用:专题4 综合检测(提升卷)
专题4 综合检测(提升卷)(已下线)【知识图鉴】单元讲练测选择性必修2第三章02练基础辽宁省大连市一0三中学2020-2021学年高二4月月考化学试题(已下线)作业09 配合物与超分子-2021年高二化学暑假作业(人教版2019)四川省乐山市峨眉第二中学2022-2023学年高二上学期期中考试化学试题辽宁省沈阳市第十五中学2022-2023学年高二下学期4月月考化学试题黑龙江省双鸭山市第一中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
10 . 关于化学式[TiCl(H2O)5]Cl2⋅H2O的配合物的下列说法中正确的是
| A.配位体是Cl-和H2O,配位数是9 |
| B.配离子是[TiCl(H2O)5]2+,中心离子是Ti4+ |
| C.内界和外界中的Cl-的数目比是1:2 |
| D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
您最近一年使用:0次
2023-06-25更新
|
359次组卷
|
74卷引用:2017-2018学年人教版高中化学选修三 模块综合质量检测
2017-2018学年人教版高中化学选修三 模块综合质量检测(已下线)2013-2014甘肃省兰州一中下学期期中考试高二化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年辽宁鞍山一中高二下期中化学试卷2014-2015学年陕西西北大学附中高二下期末化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷2017届福建省华安一中高三上学期开学考试化学试卷2016-2017学年山西省太原市外国语学校高二下学期第一次月考化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题(已下线)2019年3月9日 《每日一题》人教选修3-周末培优(已下线)2019年4月13日 《每日一题》选修3-周末培优吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题吉林省延边第二中学2018-2019学年高二下学期期末考试化学试题山东省聊城市冠县2020届高三10月月考化学试题湖北省宜昌市第二中学2018-2019学年高二上学期期中考试化学试题2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题第3节 离子键、配位键与金属键——A学习区 夯实基础(鲁科版选修3)河北省枣强中学2019-2020学年高二下学期第三次月考化学试题四川省越西中学2019-2020学年高二5月月考化学试题山西省晋中市平遥中学2019-2020高二下学期在线学习质量检测化学试题河北省博野中学2019-2020学年高二下学期开学考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题辽宁省沈阳市郊联体2019-2020学年高二下学期期中考试化学试题福建省莆田市莆田第二十五中学2019-2020学年高二下学期期末考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)第36讲 分子结构与性质(精练)-2021年高考化学一轮复习讲练测新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题(已下线)专题18 物质结构与性质-备战2021届高考化学二轮复习题型专练吉林省前郭尔罗斯蒙古族自治县蒙古族中学2020-2021学年高二下学期第一次月考化学试题福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题天津市第三中学2020-2021学年高二下学期期中考试化学试题福建省龙岩市长汀县三级达标校2020-2021学年高二下学期期中考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题福建省永泰县第一中学2020-2021学年高二下学期期中考试化学试题福建省仙游县枫亭中学2020-2021学年高二下学期期中考试化学试题新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题河南省商丘市柘城县柘城第四高级中学2020-2021学年高二下学期期末考试化学(理)试题辽宁省鞍山市2020-2021学年高二下学期期末考试化学试题黑龙江省绥化市第一中学2020-2021学年高二下学期期中考试化学试题江苏省淮安市高中校协作体2021-2022学年高三上学期期中考试化学试题福建省德化第一中学2021-2022学年高二下学期第一次质检化学试题河南省南阳市第一中学校2021-2022学年高二下学期第四次月考化学试题湖南省衡阳市第一中学2021-2022学年高二下学期5月月考化学试题福建省福州市四校联盟2021-2022学年高二下学期期中联考化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题湖北省武汉市钢城第四中学2021-2022学年高二下学期期中考试化学试题浙江省杭州市源清中学2021-2022学年高二下学期期中考试化学试题(已下线)第31讲 晶体结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)宁夏银川市景博中学2021-2022学年高二下学期第二次月考化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题四川省遂宁中学校2022-2023学年高二上学期10月月考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第三次月考化学试题山西省朔州市怀仁市大地学校2021-2022学年高二下学期第一次月考化学试题重庆市璧山来凤中学2022-2023学年高二下学期第一次月考化学试题河南省灵宝市第一高级中学2022-2023学年高二下学期3月月考化学试题四川省广元中学2021-2022学年高二下学期第一次段考化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题宁夏银川市唐徕中学2022-2023学年高二下学期期中考试化学试题北京市汇文中学2021-2022学年高二下学期期中考试化学试题江苏省江阴市华士高级中学2023-2024学年高二上学期10月学情调研化学(选修)试题(已下线)3.4 配合物与超分子-随堂练习山东省临沂市平邑县第一中学西校区2023-2024学年高二下学期四月份阶段性考试化学试题北京市大兴区第一中学2023-2024学年高二下学期期中考试化学试题(已下线)3.4 配合物与超分子课堂例题



