名校
解题方法
1 . 分类是学化学的重要方法,下列分类正确的是
A.醇类: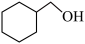 和 和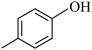 | B.电子云轮廓图为球形:2s、2p、3s |
| C.共价晶体:锗、硅和金刚石 | D.配合物: 和 和 |
您最近一年使用:0次
名校
解题方法
2 . 配合物在生产、生活中应用广泛。例如, (铁氰化钾)用于检验
(铁氰化钾)用于检验 ,
, 用于检验
用于检验 。回答下列问题:
。回答下列问题:
(1)基态 的价层电子排布式为
的价层电子排布式为___________ ,向某未知溶液中滴加适量 溶液,若
溶液,若___________ (填实验现象),则说明溶液中含有 。
。
(2) 中配位原子是
中配位原子是___________ (填元素符号)。
(3)已知:络合平衡反应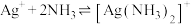 ,其平衡常数又称配离子稳定常数,
,其平衡常数又称配离子稳定常数,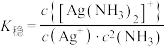 。常温下,
。常温下,
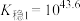 ;
;
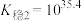 。
。
由此推知稳定性:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是___________ 。
(4)分裂能( )定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能(
)定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能( ):
):
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是___________ 。
 (铁氰化钾)用于检验
(铁氰化钾)用于检验 ,
, 用于检验
用于检验 。回答下列问题:
。回答下列问题:(1)基态
 的价层电子排布式为
的价层电子排布式为 溶液,若
溶液,若 。
。(2)
 中配位原子是
中配位原子是(3)已知:络合平衡反应
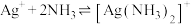 ,其平衡常数又称配离子稳定常数,
,其平衡常数又称配离子稳定常数,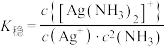 。常温下,
。常温下,
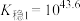 ;
;
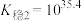 。
。由此推知稳定性:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是(4)分裂能(
 )定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能(
)定义:1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,分裂能大小与配体、中心原子(或离子)有关。分裂能( ):
):
 (填“
(填“ ”“
”“ ”或“
”或“ ”),判断依据是
”),判断依据是
您最近一年使用:0次
名校
解题方法
3 . 化学与人类生产、生活息息相关。下列叙述错误的是
| A.18—冠—6分子可识别K+,因此可增大KI在苯中的溶解度 |
| B.向硫酸四氨合铜溶液中加入乙醇会析出深蓝色晶体,因为乙醇的极性比水小 |
| C.壁虎能在天花板上爬行,是因为它的细毛与墙体之间有范德华力 |
| D.“杯酚”可分离C60和C70,体现了超分子的“自组装”特性 |
您最近一年使用:0次
4 . 已知:铜离子的配位数通常为4, 和
和 均为深蓝色,某小组同学设计以下方案研究铜的配合物。下列说法错误的是
均为深蓝色,某小组同学设计以下方案研究铜的配合物。下列说法错误的是
 和
和 均为深蓝色,某小组同学设计以下方案研究铜的配合物。下列说法错误的是
均为深蓝色,某小组同学设计以下方案研究铜的配合物。下列说法错误的是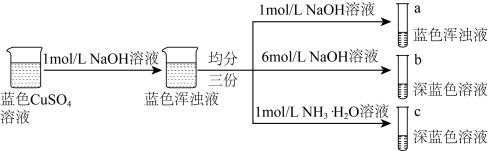
A.b、c溶液中 相同 相同 |
B.b中得到配合物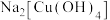 ,其配体为 ,其配体为 |
C.由实验可知, 的配位能力比 的配位能力比 弱 弱 |
D.a、b、c三种溶液中加入 溶液均会产生白色沉淀 溶液均会产生白色沉淀 |
您最近一年使用:0次
名校
5 . 反应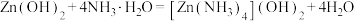 中的有关物质的说法不正确的是
中的有关物质的说法不正确的是
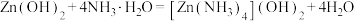 中的有关物质的说法不正确的是
中的有关物质的说法不正确的是A.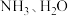 固态时均属于分子晶体 固态时均属于分子晶体 |
B.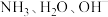 均为 均为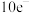 微粒 微粒 |
C. 分子中的键角 分子中的键角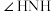 比 比 中的键角 中的键角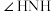 大 大 |
D. 中存在离子键、配位键、极性键 中存在离子键、配位键、极性键 |
您最近一年使用:0次
名校
解题方法
6 . 蓝铜矿的主要成分为2CuCO3·Ca(OH)2,将它与焦炭一起加热可以生成Cu、CO2和H2O。下列说法正确的是
| A.Cu是第四周期第ⅦB族元素 |
| B.0.1mol[Cu(H2O)4]2+中所含配位键的物质的量为0.8mol |
| C.电负性:O>C>H |
| D.将0.1L0.1mol/L[Cu(NH3)4](OH)2加入足量的MgCl2溶液中,理论上可得到0.2molMg(OH)2 |
您最近一年使用:0次
7 . Ⅰ.经研究表明,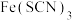 是配合物,
是配合物, 与
与 不仅能以1:3的个数比配合,还可以其他个数比配合。
不仅能以1:3的个数比配合,还可以其他个数比配合。
(1) 中所有原子都达到
中所有原子都达到 稳定结构,请画出
稳定结构,请画出 的结构式
的结构式______ ,若其中主要是 与
与 以个数比1:1配合所得离子,显血红色,该离子的离子符号是
以个数比1:1配合所得离子,显血红色,该离子的离子符号是______ 。
(2)若 与
与 以个数比1:5配合,则
以个数比1:5配合,则 与KSCN在水溶液中发生反应的化学方程式可以表示为
与KSCN在水溶液中发生反应的化学方程式可以表示为______ 。
(3)Fe还能与CO形成配合物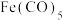 ,该配合物中的配位原子是
,该配合物中的配位原子是______ (写元素符号)。
(4) 溶液可吸收NO生成配合物
溶液可吸收NO生成配合物 ,减少环境污染。下列说法正确的是 。
,减少环境污染。下列说法正确的是 。
Ⅱ.铜的单质及其化合物应用广泛:研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;硫酸铜可用于制农药波尔多液。
(5)向硫酸铜溶液中逐滴加入氨水,形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请画出深蓝色离子的结构。______ ;再加入乙醇后,析出深蓝色的晶体,请写出深蓝色晶体的化学式:______ 。
(6)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色溶液,写出离子方程式:______ 。
(7) 结构示意图如下,
结构示意图如下, 中存在的相互作用有
中存在的相互作用有______ (填序号)。
(8)青霉胺可用于医学上误食铜盐的解毒,解毒原理: 形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
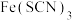 是配合物,
是配合物, 与
与 不仅能以1:3的个数比配合,还可以其他个数比配合。
不仅能以1:3的个数比配合,还可以其他个数比配合。(1)
 中所有原子都达到
中所有原子都达到 稳定结构,请画出
稳定结构,请画出 的结构式
的结构式 与
与 以个数比1:1配合所得离子,显血红色,该离子的离子符号是
以个数比1:1配合所得离子,显血红色,该离子的离子符号是(2)若
 与
与 以个数比1:5配合,则
以个数比1:5配合,则 与KSCN在水溶液中发生反应的化学方程式可以表示为
与KSCN在水溶液中发生反应的化学方程式可以表示为(3)Fe还能与CO形成配合物
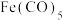 ,该配合物中的配位原子是
,该配合物中的配位原子是(4)
 溶液可吸收NO生成配合物
溶液可吸收NO生成配合物 ,减少环境污染。下列说法正确的是 。
,减少环境污染。下列说法正确的是 。| A.该配合物中所含非金属元素均位于元素周期表的p区 |
B. 提供孤电子对用于形成配位键 提供孤电子对用于形成配位键 |
| C.该配合物中阴离子空间结构为正四面体形 |
D.配离子为 ,中心离子的配位数为5 ,中心离子的配位数为5 |
Ⅱ.铜的单质及其化合物应用广泛:研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;硫酸铜可用于制农药波尔多液。
(5)向硫酸铜溶液中逐滴加入氨水,形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请画出深蓝色离子的结构。
(6)金属铜与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应得到深蓝色溶液,写出离子方程式:
(7)
 结构示意图如下,
结构示意图如下, 中存在的相互作用有
中存在的相互作用有
(8)青霉胺可用于医学上误食铜盐的解毒,解毒原理:
 形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
形成环状配合物,其结构如图所示,该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是 。
A.共价键键角的大小关系为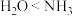 |
B.电负性大小关系为 |
| C.该配合物易溶于水的主要原因是其与水可形成分子间氢键 |
D.与铜离子形成配位键强弱的大小关系为 |
您最近一年使用:0次
名校
8 . 铜、钛、钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的价电子轨道表示式为___________ ,未成对电子数为___________ 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。与 互为等电子体的阳离子的化学式为
互为等电子体的阳离子的化学式为___________ 。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。___________ (填碳原子旁标的序号)。
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___________ 。根据价电子对互斥理论,预测[Co(NH3)4(H2O)2]2+的立体构型为___________ 体(填相关的立体构型)。
(5)我们通过学习,已经了解到Fe3+溶液在不同溶液中会显示不同的颜色,例如:[Fe(H2O)6]3+溶液显浅紫色(接近无色,肉眼几乎看不见浅紫色);[FeCl4(H2O)2]-溶液显黄色,[Fe(H2O)6-n(OH)n]3-n溶液显黄色。
已知Fe3+溶液存在以下平衡:
[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6-n(OH)n]3-n+nH3O+(正向为Fe3+水解)
[Fe(H2O)6]3++4Cl-⇌[FeCl4(H2O)2]-+4H2O请用上述平衡预测:
若两只盛有等量的Fe(NO3)3固体的试管,向第一只试管加1mL水,向第二只试管加1mL1mol/L稀硝酸,第一只试管发生的现象是___________ ,第二只试管发生的现象是___________ 。
(6)铜与类卤素(SCN)2反应生成Cu(SCN)2,HSCN结构有两种,分别是硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),沸点高的是___________ ,沸点高的原因是:___________ 。
(7)NH4HF2中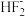 的结构为F-H…F-,则NH4HF2中含有的化学键有
的结构为F-H…F-,则NH4HF2中含有的化学键有___________ (填标号)。
A.氢键 B.价键 C.金属键 D.离子键 E.配位键
(1)钴元素基态原子的价电子轨道表示式为
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。与
 互为等电子体的阳离子的化学式为
互为等电子体的阳离子的化学式为(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为
(5)我们通过学习,已经了解到Fe3+溶液在不同溶液中会显示不同的颜色,例如:[Fe(H2O)6]3+溶液显浅紫色(接近无色,肉眼几乎看不见浅紫色);[FeCl4(H2O)2]-溶液显黄色,[Fe(H2O)6-n(OH)n]3-n溶液显黄色。
已知Fe3+溶液存在以下平衡:
[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6-n(OH)n]3-n+nH3O+(正向为Fe3+水解)
[Fe(H2O)6]3++4Cl-⇌[FeCl4(H2O)2]-+4H2O请用上述平衡预测:
若两只盛有等量的Fe(NO3)3固体的试管,向第一只试管加1mL水,向第二只试管加1mL1mol/L稀硝酸,第一只试管发生的现象是
(6)铜与类卤素(SCN)2反应生成Cu(SCN)2,HSCN结构有两种,分别是硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),沸点高的是
(7)NH4HF2中
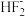 的结构为F-H…F-,则NH4HF2中含有的化学键有
的结构为F-H…F-,则NH4HF2中含有的化学键有A.氢键 B.价键 C.金属键 D.离子键 E.配位键
您最近一年使用:0次
名校
9 . 下列现象与形成配合物无关的是
| A.向FeCl3溶液中滴入KSCN溶液呈红色 |
B.向Cu与 反应后的集气瓶中加少量水,呈绿色,再加水,呈蓝色 反应后的集气瓶中加少量水,呈绿色,再加水,呈蓝色 |
C.Cu与浓 反应后,溶液呈绿色;Cu与稀 反应后,溶液呈绿色;Cu与稀 反应后,溶液呈蓝色 反应后,溶液呈蓝色 |
| D.向AgNO3溶液中逐滴滴加氨水至过量,先出现白色沉淀,继而沉淀消失 |
您最近一年使用:0次
10 . 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
(1)基态锰原子的简化电子排布式为___________ 。
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为___________ 。
(3)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为___________ 。
(4)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是___________ 。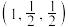 ,b点锰原子坐标为
,b点锰原子坐标为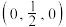 ,则c点锰原子坐标为
,则c点锰原子坐标为___________ 。
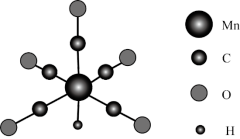
(1)基态锰原子的简化电子排布式为
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为
(3)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为
(4)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是
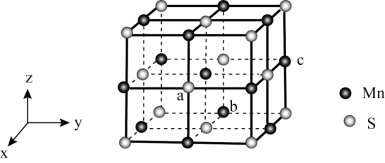
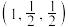 ,b点锰原子坐标为
,b点锰原子坐标为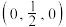 ,则c点锰原子坐标为
,则c点锰原子坐标为
您最近一年使用:0次



