1 . 配合物能定性可用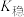 表示,对于配位反应:
表示,对于配位反应: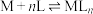
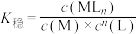 (M代表中心离子或原子,L代表配体)。
(M代表中心离子或原子,L代表配体)。 的配位化合物较稳定且应用广泛,
的配位化合物较稳定且应用广泛, 可与
可与 、
、 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的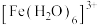 、红色的
、红色的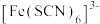 、无色的
、无色的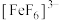 、黄色的
、黄色的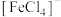 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的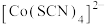 配离子;
配离子; 不能与
不能与 形成配离子。下列说法不正确的是
形成配离子。下列说法不正确的是
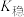 表示,对于配位反应:
表示,对于配位反应: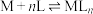
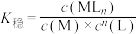 (M代表中心离子或原子,L代表配体)。
(M代表中心离子或原子,L代表配体)。 的配位化合物较稳定且应用广泛,
的配位化合物较稳定且应用广泛, 可与
可与 、
、 、
、 、
、 等配体形成使溶液呈浅紫色的
等配体形成使溶液呈浅紫色的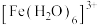 、红色的
、红色的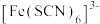 、无色的
、无色的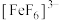 、黄色的
、黄色的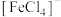 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: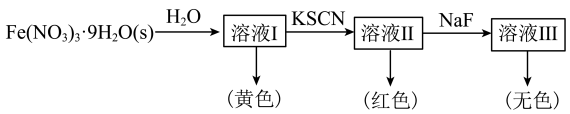
 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的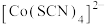 配离子;
配离子; 不能与
不能与 形成配离子。下列说法不正确的是
形成配离子。下列说法不正确的是A.为了能观察到溶液Ⅰ中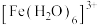 的颜色,可向该溶液中加入稀盐酸 的颜色,可向该溶液中加入稀盐酸 |
| B.向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色 |
C.可用NaF和KSCN溶液检验 溶液中是否含有 溶液中是否含有 |
D.反应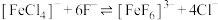 的平衡常数 的平衡常数 |
您最近一年使用:0次
名校
解题方法
2 . 从废旧CPU中回收Au、Ag、Cu的部分流程如下: ,下列说法正确的是
,下列说法正确的是

 ,下列说法正确的是
,下列说法正确的是| A.酸溶时,硝酸只体现氧化性 |
B.向过滤所得滤液中加入过量浓氨水,可以分离 、 、 |
| C.溶金时NaCl作用为增强硝酸的氧化性 |
D.向1mol 中加入过量Zn使其完全还原为Au,需消耗2mol Zn 中加入过量Zn使其完全还原为Au,需消耗2mol Zn |
您最近一年使用:0次
名校
3 . “嫦娥五号”首次实现了我国地外天体采样返回,带回的月壤中包含了H、O、N、A1、S、Cd、Zn、Ti、Cu、Au、Cr等多种元素。回答下列问题:
(1)锌(Zn)、镉(Cd)是同一副族的相邻元素,Cd的原子序数更大,则基态Cd原子的价电子轨道表示式为___________ 。
(2)若配离子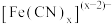 的中心离子价电子数与配体提供的电子数之和为18,则x=
的中心离子价电子数与配体提供的电子数之和为18,则x=___________ 。
(3)碲和硫同主族,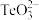 的空间构型为
的空间构型为___________ ,写出一个与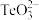 互为等电子体的分子
互为等电子体的分子___________ 。
(4)咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:___________ (填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为___________ 。
③已知咪唑中存在大 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是___________ (填“①”或“②”)号氮原子。
(5)“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),已知该结构单元底面(正六边形)边长为anm,该合金的密度为 ,则h=
,则h=___________ cm(列出计算式,设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
(1)锌(Zn)、镉(Cd)是同一副族的相邻元素,Cd的原子序数更大,则基态Cd原子的价电子轨道表示式为
(2)若配离子
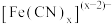 的中心离子价电子数与配体提供的电子数之和为18,则x=
的中心离子价电子数与配体提供的电子数之和为18,则x=(3)碲和硫同主族,
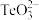 的空间构型为
的空间构型为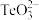 互为等电子体的分子
互为等电子体的分子(4)咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

②吡啶中氮原子的杂化轨道的空间构型为
③已知咪唑中存在大
 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是(5)“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),已知该结构单元底面(正六边形)边长为anm,该合金的密度为
 ,则h=
,则h= 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)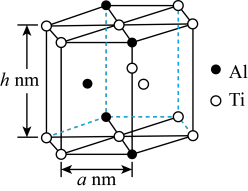
您最近一年使用:0次
4 . 砷化镓是一种高性能半导体材料,被广泛应用于光电子器件等领域。砷化镓立方晶胞(晶胞参数为 )如图1。下列说法正确的是
)如图1。下列说法正确的是
 )如图1。下列说法正确的是
)如图1。下列说法正确的是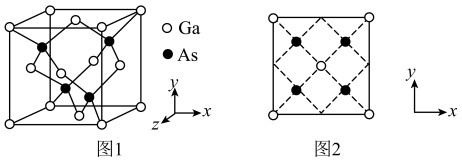
A. 的配位数为2 的配位数为2 | B.该晶胞沿z轴方向的平面投影如图2 |
| C.晶体中配位键占共价键总数的25% | D.晶胞中砷原子与镓原子间的最短距离为 |
您最近一年使用:0次
昨日更新
|
516次组卷
|
4卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
解题方法
5 . 某实验小组以粗镍(含少量 和
和 杂质)为原料制备
杂质)为原料制备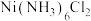 ,并测定相关组分的含量,制备流程示意图如下:
,并测定相关组分的含量,制备流程示意图如下: 为绿色难溶物;
为绿色难溶物;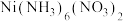 、
、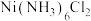 均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是
均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是
 和
和 杂质)为原料制备
杂质)为原料制备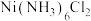 ,并测定相关组分的含量,制备流程示意图如下:
,并测定相关组分的含量,制备流程示意图如下:
 为绿色难溶物;
为绿色难溶物;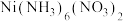 、
、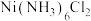 均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是
均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是A.试剂X的作用是调节 除去 除去 和 和 杂质,则试剂X可为 杂质,则试剂X可为 |
B. 过程的转化离子方程式为 过程的转化离子方程式为 |
C.实验配制3.0 稀硝酸250 稀硝酸250 需要的玻璃仪器有烧杯、量筒、玻璃棒、250 需要的玻璃仪器有烧杯、量筒、玻璃棒、250 容量瓶 容量瓶 |
| D.步骤c、d中为防止氨水分解及降低固体溶解度需0~10℃冷水浴控温,则温度计应在水浴中 |
您最近一年使用:0次
解题方法
6 . 氮氧化物( )是硝酸和肼等工业的主要污染物。一种以沸石笼作为载体对氮氧化物进行催化还原的原理及A在沸石笼内转化为B、C、D等中间体的过程如图,下列说法不正确的是
)是硝酸和肼等工业的主要污染物。一种以沸石笼作为载体对氮氧化物进行催化还原的原理及A在沸石笼内转化为B、C、D等中间体的过程如图,下列说法不正确的是
 )是硝酸和肼等工业的主要污染物。一种以沸石笼作为载体对氮氧化物进行催化还原的原理及A在沸石笼内转化为B、C、D等中间体的过程如图,下列说法不正确的是
)是硝酸和肼等工业的主要污染物。一种以沸石笼作为载体对氮氧化物进行催化还原的原理及A在沸石笼内转化为B、C、D等中间体的过程如图,下列说法不正确的是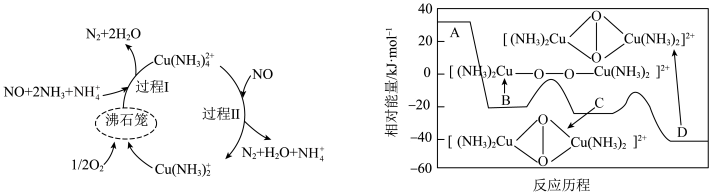
A.脱除 的总反应为 的总反应为 |
B.其他条件不变时,增大 , , 的平衡转化率下降 的平衡转化率下降 |
| C.A、B、C、D中比较稳定是D |
| D.沸石笼中的反应过程氧化剂与还原剂的物质的量比为1:2 |
您最近一年使用:0次
7 . 实验装置为实验提供必要条件和测量手段。如图装置不能达到实验目的的是
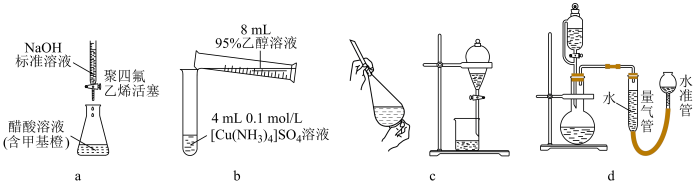
| A.图a测定醋酸溶液的浓度 |
| B.图b制备[Cu(NH3)4]SO4•H2O晶体 |
| C.图c用NaOH溶液除去溴苯中的溴单质 |
| D.图d测定一定质量的Na2O2和Na2O混合物中Na2O2的含量 |
您最近一年使用:0次
7日内更新
|
531次组卷
|
3卷引用:辽宁省重点高中协作校2024届高三下学期第二次模拟考试化学试题
名校
8 . 硫酸四氨合铜晶体{[Cu(NH3)4]SO4∙H2O}在工业上用途广泛,常温下该物质在空气中不稳定,受热时易发生分解。现以铜粉、3mol/L的硫酸、浓氨水、10%NaOH溶液、95%的乙醇溶液、0.500mol/L稀盐酸、0.500mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(已知:CuSO4在水中的溶解度随温度的升高而增大。)
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为___________ 。
(2)第③步中,趁热过滤的目的是___________ 。
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作___________ 。
(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:___________ ,此处不采用浓缩结晶的原因是___________ 。
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。___________ 。
(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用___________ (填“酚酞”或“甲基橙”)作指示剂。
(7)样品中氨的质量分数的表达式为___________ (用含w、V1、V2的代数式表式)。
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为
(2)第③步中,趁热过滤的目的是
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作

(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用
(7)样品中氨的质量分数的表达式为
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
| A.滴定时未用NaOH标准溶液润洗滴定管 |
| B.读数时,滴定前平视,滴定后俯视 |
| C.将样品液中的氨全部蒸出后,未用蒸馏水冲洗导管内壁 |
| D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁 |
您最近一年使用:0次
7日内更新
|
104次组卷
|
2卷引用:福建省福州市八县市一中2024届高三下学期模拟联考化学试题
名校
解题方法
9 . 从硝酸铜和硝酸银的混合溶液中回收铜和银的流程如图所示。

| A.试剂Ⅰ可以是稀盐酸或稀硫酸 |
| B.流程中涉及的反应均是氧化还原反应 |
C.生成银氨溶液的离子方程式为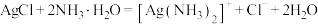 |
D.若试剂Ⅱ是甲醛, 甲醛参加反应最多生成 甲醛参加反应最多生成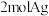 |
您最近一年使用:0次
7日内更新
|
82次组卷
|
3卷引用:山东省日照市五莲天立学校2024届高三(高复)下学期二模前模拟考试化学试题
名校
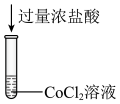
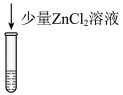
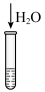
10 . 某小组对 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是
资料:
 的性质进行探究,实验操作及现象如下,下列说法不正确的是
的性质进行探究,实验操作及现象如下,下列说法不正确的是资料:
| 物质 |  |  |  |
| 溶液中的颜色 | 粉红色 | 蓝色 | 无色 |
| 操作 |
| 将a中得到的蓝色溶液均分为3份,分别倒入试管 、 、 、 、 中 中 | ||
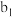 |
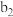 |
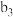 | ||
| 现象 | a中现象:加入浓盐酸后,溶液由粉红色变为蓝色 | 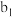 中现象:溶液变为粉红色 中现象:溶液变为粉红色 |  中现象 中现象 |  中现象 中现象 |
A.试管a中存在平衡: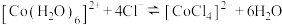 |
B.由 中现象可推测稳定性: 中现象可推测稳定性: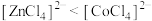 |
C. 中现象可能为产生白色沉淀 中现象可能为产生白色沉淀 |
D.推测 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 中现象为溶液变为粉红色,因为加入水使各组分离子浓度变化,平衡移动 |
您最近一年使用:0次
7日内更新
|
169次组卷
|
2卷引用:北京市昌平区2023-2024学年高三下学期二模化学试题