名校
解题方法
1 . 某课外小组探究Cu(Ⅱ)盐与Na2S2O3溶液的反应。
【查阅资料】
ⅰ. 2 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):
ⅱ. 2NH3+Cu+ [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;
假设2:Cu(Ⅱ)有氧化性,Cu2+与 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是___________ (填化学式)。
(2)甲同学认为实验一可证明假设2成立,他的理由是___________ 。
实验二:探究CuCl2与Na2S2O3的反应。___________ (补全实验方案),则说明含Cu(Ⅰ)。
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:___________ 。
(5)经检验氧化产物以 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n( ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生___________ 的趋势减弱;
②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和 发生
发生___________ 的趋势。
【查阅资料】
ⅰ. 2
 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):ⅱ. 2NH3+Cu+
 [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与
 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;假设2:Cu(Ⅱ)有氧化性,Cu2+与
 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
| 实验操作 | 实验序号 | V1(mL) | V2(mL) | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是
(2)甲同学认为实验一可证明假设2成立,他的理由是
实验二:探究CuCl2与Na2S2O3的反应。
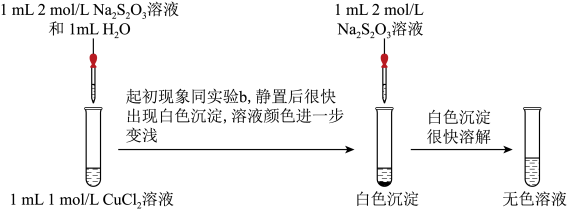
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:
(5)经检验氧化产物以
 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n(
 ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和
 发生
发生
您最近一年使用:0次
名校
解题方法
2 . 钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,可通过如下反应制备:2CoCl2+2NH4Cl+10NH3+H2O2 [CO(NH3)6]Cl3+2H2O具体步骤如下:
[CO(NH3)6]Cl3+2H2O具体步骤如下:
①称取2.00gNH4Cl,用5mL水溶解。
②分批加入2.38gCoCl2·6H2O后,将溶液温度降至10℃以下,加入少许活性炭、10mL12mol/L浓氨水,搅拌下逐滴加入10mL0.6mol/L的双氧水。
③加热至55~60℃反应20min,冷却,过滤。
④将滤得的固体转入含有少量盐酸的25mL沸水中,趁热过滤洗涤。
⑤滤液洗涤液转入烧杯,加入4mL浓盐酸,经过一系列操作,最终得到晶体2.0g。
依据上述实验原理,下列说法正确的是
 [CO(NH3)6]Cl3+2H2O具体步骤如下:
[CO(NH3)6]Cl3+2H2O具体步骤如下:①称取2.00gNH4Cl,用5mL水溶解。
②分批加入2.38gCoCl2·6H2O后,将溶液温度降至10℃以下,加入少许活性炭、10mL12mol/L浓氨水,搅拌下逐滴加入10mL0.6mol/L的双氧水。
③加热至55~60℃反应20min,冷却,过滤。
④将滤得的固体转入含有少量盐酸的25mL沸水中,趁热过滤洗涤。
⑤滤液洗涤液转入烧杯,加入4mL浓盐酸,经过一系列操作,最终得到晶体2.0g。
依据上述实验原理,下列说法正确的是
| A.步骤②中逐滴加入10mL0.6mol/L的双氧水做氧化剂且全部反应 |
| B.步骤②中应用冷水浴降温,目的只是为了防止双氧水分解 |
| C.步骤④趁热过滤得到的固体要用冷水洗涤 |
| D.步骤⑤中滤液加入4mL浓盐酸,是为了析出更多的产品 |
您最近一年使用:0次
3 . 配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1) 可以形成多种配离子,如
可以形成多种配离子,如 、
、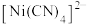 、丁二酮肟镍分子(见图1)等。
、丁二酮肟镍分子(见图1)等。
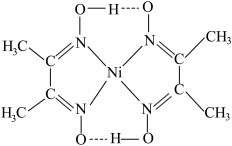
图1
① 中
中 键角比
键角比 分子中
分子中 键角
键角___________ (填“大”或“小”)。
②丁二酮肟镍分子内含有的作用力有___________ (填字母)。
a.配位键 b.离子键 c.氢键 d.金属键
(2)关于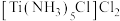 的说法中错误的是
的说法中错误的是___________ 。
A.中心原子的化合价为 价
价
B.中心原子的配位数是6
C.含 的水溶液中加入足量
的水溶液中加入足量 ,溶液,产生
,溶液,产生 白色沉淀
白色沉淀
(3)已知 立体结构如图2,其中1~6处的小圆圈表示
立体结构如图2,其中1~6处的小圆圈表示 分子,且各相邻的
分子,且各相邻的 分子间的距离相等(图中虚线长度相等)。
分子间的距离相等(图中虚线长度相等)。 位于正八面体的中心,若其中两个
位于正八面体的中心,若其中两个 被
被 取代,所形成的
取代,所形成的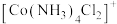 的结构的数目为
的结构的数目为___________ 。
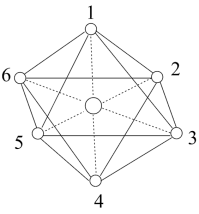
图2
(1)
 可以形成多种配离子,如
可以形成多种配离子,如 、
、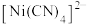 、丁二酮肟镍分子(见图1)等。
、丁二酮肟镍分子(见图1)等。
图1
①
 中
中 键角比
键角比 分子中
分子中 键角
键角②丁二酮肟镍分子内含有的作用力有
a.配位键 b.离子键 c.氢键 d.金属键
(2)关于
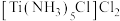 的说法中错误的是
的说法中错误的是A.中心原子的化合价为
 价
价B.中心原子的配位数是6
C.含
 的水溶液中加入足量
的水溶液中加入足量 ,溶液,产生
,溶液,产生 白色沉淀
白色沉淀(3)已知
 立体结构如图2,其中1~6处的小圆圈表示
立体结构如图2,其中1~6处的小圆圈表示 分子,且各相邻的
分子,且各相邻的 分子间的距离相等(图中虚线长度相等)。
分子间的距离相等(图中虚线长度相等)。 位于正八面体的中心,若其中两个
位于正八面体的中心,若其中两个 被
被 取代,所形成的
取代,所形成的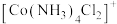 的结构的数目为
的结构的数目为
图2
您最近一年使用:0次
名校
解题方法
4 . 下列反应的离子方程式正确的是
A.氢氧化铁悬浊液溶于氢碘酸溶液中: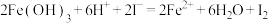 |
B.用 溶液腐蚀铜板制印刷电路: 溶液腐蚀铜板制印刷电路: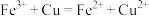 |
C.向血红色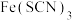 溶液中加入过量铁粉至溶液褪色: 溶液中加入过量铁粉至溶液褪色: |
D.向 溶液中加入过量氨水: 溶液中加入过量氨水: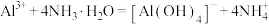 |
您最近一年使用:0次
名校
解题方法
5 . 下列实验过程中,始终无明显现象的是
| A.将CuSO4溶液滴入NaOH溶液中 | B.将CO2通入CaCl2溶液中 |
| C.将稀盐酸滴入Na2CO3溶液中 | D.向澄清的石灰水中通入CO2直至过量 |
您最近一年使用:0次
名校
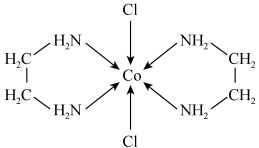
6 . 钴( )元素容易形成配合物,其常见+2、+3价。
)元素容易形成配合物,其常见+2、+3价。
(1)已知配合物的磁矩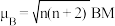 (n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,乙二胺(
(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,乙二胺(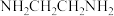 )为电中性配体],若测得其
)为电中性配体],若测得其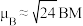 ,则该离子所带电荷数目及符号为
,则该离子所带电荷数目及符号为___________ 。
(2)中子衍射实验证实,晶体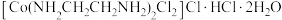 中仅存在3种离子(不存在分子):
中仅存在3种离子(不存在分子): 、
、 和上述含钴配离子。该晶体中存在的化学键类型有
和上述含钴配离子。该晶体中存在的化学键类型有___________ ;含钴配离子中提供孤电子对的原子是_________ ,配位数是_________ ; 是
是___________ (填离子符号)。
(3)乙二胺(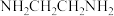 )与正丁烷(
)与正丁烷( )的相对分子质量相近,乙二胺沸点比正丁烷高的原因是
)的相对分子质量相近,乙二胺沸点比正丁烷高的原因是___________ 。
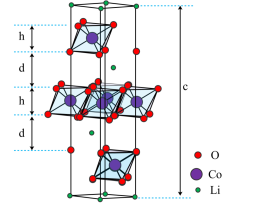
(4)钴酸锂( )是常见的锂离子电池正极材料,其晶胞结构如图所示。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与
)是常见的锂离子电池正极材料,其晶胞结构如图所示。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与 层交替排列。该晶胞中O的个数为
层交替排列。该晶胞中O的个数为___________ ;充电过程中晶胞高度c变大,原因是 会从八面体层间脱出,导致
会从八面体层间脱出,导致___________ 。
 )元素容易形成配合物,其常见+2、+3价。
)元素容易形成配合物,其常见+2、+3价。(1)已知配合物的磁矩
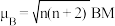 (n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,乙二胺(
(n表示中心原子或离子的未成对电子数)。某含钴配离子结构如图所示[所带电荷数目及符号未标出,乙二胺(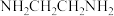 )为电中性配体],若测得其
)为电中性配体],若测得其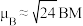 ,则该离子所带电荷数目及符号为
,则该离子所带电荷数目及符号为
(2)中子衍射实验证实,晶体
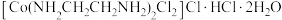 中仅存在3种离子(不存在分子):
中仅存在3种离子(不存在分子): 、
、 和上述含钴配离子。该晶体中存在的化学键类型有
和上述含钴配离子。该晶体中存在的化学键类型有 是
是(3)乙二胺(
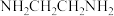 )与正丁烷(
)与正丁烷( )的相对分子质量相近,乙二胺沸点比正丁烷高的原因是
)的相对分子质量相近,乙二胺沸点比正丁烷高的原因是(4)钴酸锂(
 )是常见的锂离子电池正极材料,其晶胞结构如图所示。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与
)是常见的锂离子电池正极材料,其晶胞结构如图所示。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与 层交替排列。该晶胞中O的个数为
层交替排列。该晶胞中O的个数为 会从八面体层间脱出,导致
会从八面体层间脱出,导致
您最近一年使用:0次
7 . 某同学进行如下实验:
①分别向 溶液和
溶液和 溶液中滴加KSCN溶液,均无明显现象。
溶液中滴加KSCN溶液,均无明显现象。
②向 和
和 的混合液中滴加KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。
的混合液中滴加KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。
③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。
已知:CuSCN为白色、难溶性物质: 为无色离子。
为无色离子。
下列说法不正确 的是
①分别向
 溶液和
溶液和 溶液中滴加KSCN溶液,均无明显现象。
溶液中滴加KSCN溶液,均无明显现象。②向
 和
和 的混合液中滴加KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。
的混合液中滴加KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。
已知:CuSCN为白色、难溶性物质:
 为无色离子。
为无色离子。下列说法
A.实验①说明 不能与 不能与 反应生成CuSCN 反应生成CuSCN |
B.实验②中红色褪去的原因是振荡后 降低 降低 |
C.实验③中无色溶液变蓝色的原因是: |
D.依据实验①、②、③推测,②中由于生成CuSCN,使 氧化性增强,将 氧化性增强,将 氧化为 氧化为 |
您最近一年使用:0次
名校
8 . 已知:铜离子的配位数通常为4, 和
和 均为深蓝色。某化学小组设计如下实验制备铜的配合物。下列说法错误的是
均为深蓝色。某化学小组设计如下实验制备铜的配合物。下列说法错误的是

 和
和 均为深蓝色。某化学小组设计如下实验制备铜的配合物。下列说法错误的是
均为深蓝色。某化学小组设计如下实验制备铜的配合物。下列说法错误的是
A.硫酸铜溶液呈蓝色是因为 与H2O结合形成 与H2O结合形成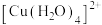 ,该配离子构型为正方形 ,该配离子构型为正方形 |
B.b中得到配合物Na2[Cu(OH)4],其配体为 |
C.由实验可知,NH3的配位能力比 弱 弱 |
| D.a、b、c三种溶液中加入BaCl2溶液均会产生白色沉淀 |
您最近一年使用:0次
9 . 金属羰基离子[Re4(CO)16]2-满足EAN规则。据此计算该配合物中含有几根Re-Re键?
| A.3 | B.4 | C.5 | D.6 |
您最近一年使用:0次
2023-05-25更新
|
209次组卷
|
2卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
名校
10 . 按照路易斯酸碱理论,在反应中接受电子对的物质为酸,在反应中给出电子对的物质为碱。酸可分为硬酸(半径小,电荷高)和软酸(半径大、电荷低),碱可以分为硬碱(给出电子对的原子电负性大)和软碱(给出电子对的原子电负性小)。软硬酸碱结合的原则是:软亲软,硬亲硬;软和硬,不稳定。下列微粒稳定性次序正确的是
A. | B. |
C. | D. |
您最近一年使用:0次
2023-05-18更新
|
340次组卷
|
3卷引用:山东省潍坊市临朐县第一中学2023-2024学年高一上学期12月月考化学试题




